1. Introducción
Los hongos oportunistas de la especie Candida han sido asociados con un amplio espectro de infecciones humanas con tasas significativas de morbilidad y mortalidad, que van desde infecciones superficiales de la piel hasta candidiasis profundas o diseminadas, entre las que se encuentran la candidiasis vulvovaginal que afecta aproximadamente al 75% de las mujeres en al menos un episodio en su vida, siendo ocasionada por Candida albicans (Hel-Houssaini et al., 2019).
Las especies de Candida son comensales dentro de la microbiota humana. Sin embargo, existen factores que desencadenan la expresión de factores de virulencia que generan un cambio de comensalismo a patogénesis, entre ellos se encuentran la adhesión al tejido del huésped, la respuesta al estrés ambiental, la secreción de hidrolasas y la producción de biopelículas. (Hel-Houssaini et al., 2019).
La expresión de factores de virulencia facilita la adhesión del patógeno al huésped y la evasión inmunitaria (Silva et al., 2012). Por ejemplo, la liberación de fosfolipasas conlleva a afectación de la membrana celular de la célula huésped y facilita el proceso infeccioso (Girao et al., 2008). La liberación de hemolisinas degrada la hemoglobina, liberando hierro, elemento esencial para la supervivencia del microorganismo (Yapar et al., 2011).
La terapia antifúngica para el tratamiento de candidiasis está limitada al uso de cuatro clases principales de medicamentos antifúngicos, incluidos los azoles, polienos, fluoropirimidinas y equinocardinas (Wille et al., 2013). El uso prolongado y generalizado de antifúngicos en los últimos años ha conllevado a que los microorganismos desarrollen mecanismos moleculares complejos que les brindan resistencia frente a los impactos de los antimicrobianos. Los procesos de resistencia pueden estar mediados por condiciones propias del huésped como cambios en el sistema inmunitario, que pueden derivar en la no eliminación del microorganismo o alteraciones fenotípicas y genotípicas del patógeno que le confieran tolerancia a los antimicóticos, como lo son la transición de levadura a hifa, la estabilidad genómica de las cepas, mutaciones aleatorias, cambios en la expresión génica, recombinación mitótica, cambios en los componentes del esterol de la membrana plasmática, entre otros (Kohli et al., 2002; Mukhopadyay et al., 2004; Han et al., 2011; Moran et al., 2011). Los procesos de resistencia pueden verse afectados por la naturaleza fungistática del fármaco, su dosificación y farmacocinética.
Dentro de las especies de Candida, la especie Candida albicans es responsable de cerca del 70% de candidiasis invasivas en entornos clínicos, sin embargo, en la última década especies no albicans (NAC) como Candida glabrata, Candida tropicalis, Candida parapsilosisy y Candida kruzei han sido reportados con mayor frecuencia en procesos infecciosos y como aislados resistentes a los antifúngicos. La presente revisión tiene como objetivo describir los principales mecanismos de resistencia a los antifúngicos azólicos en especies de hongos del género Candida.
2. Descripción química de los azoles.
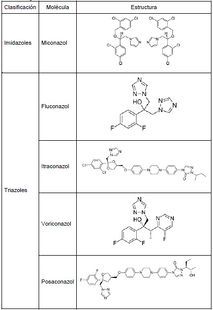
Los azoles son moléculas sintéticas con un anillo de 5 carbonos unido a una cadena alifática con un grupo fenilo. Estos antimicóticos se distinguen por las moléculas de nitrógeno presentes en el anillo azólico: 2 en el caso de los imidazoles y 3 en el caso de los triazoles (Tabla 1), su acción antifúngica está dada por su capacidad de unirse al grupo hemo que hace parte de enzimas que participan en la síntesis del ergosterol, inhibiendo el crecimiento celular, siendo la enzima 14-α demetilasa la más frecuentemente afectada. Los azoles presentan actividad frente a levaduras, dermatofitos, hongos patógenos primarios y algunos hongos miceliares.
Las levaduras del género Candida poseen como target de los azoles, la proteína Erg11p, la cual pesa aproximadamente 60 kDa y se ubica en la cara interna de la membrana del retículo endoplasmático liso, el cual posee como función la síntesis de lípidos como aceites, fosfolípidos y esteroides. La proteína Erg11p participa en la biosíntesis del ergosterol y el esterol, principales constituyentes de las membranas celulares fúngicas (Noel T, 2012). Erg11p hace parte de un complejo de óxido-reductasas, es una hemoproteína que posee un átomo de hierro cuya función principal es la oxidación sucesiva del lanosterol para eliminar su grupo metilo. Los antifúngicos azólicos se comportan como inhibidores competitivos de la fijación de O2 previniendo la desmetilación del lanosterol y conllevando a un déficit de ergosterol (Wirsching et al., 2000). Dentro de las principales funciones del ergosterol se encuentran la regulación del funcionamiento de proteínas de membrana, compartimentación de la membrana celular, la endocitosis, la fusión de vacuolas y la señalización de feromonas. Otra consecuencia de la acción de los azoles es la acumulación de esteroles metilados que resultan tóxicos para la célula fúngica, como lo son el 14α-metil-3,6-diol (Lamb et al., 1995).
3. Mecanismos de resistencia a los azoles
Las moléculas antifúngicas de azoles han sido ampliamente usadas tanto para el tratamiento de infecciones de las mucosas superficiales como para tratar infecciones micóticas profundas y diseminadas. Sin embargo, su uso extensivo derivó en el desarrollo de resistencia, este fenómeno se observó por primera vez a mediados de la década de 1980 con el tratamiento de la candidiasis orofaríngea en pacientes con VIH tratados con fluconazol. La posología adecuada y el comportamiento fungistático del fluconazol contribuyeron a la selección de aislados clínicos resistentes, en particular de Candida albicans (White ,T 1997). Al considerar tanto su frecuencia como eficacia es posible afirmar que existen tres mecanismos de resistencia a los azoles, como lo son, mutaciones puntuales en el gen ERG11 que codifica para la proteína diana del azol reduciendo la afinidad de unión del antimicótico, sobreexpresión del gen ERG11 que conlleva a un aumento en la concentración celular de la proteína objetivo y la sobreexpresión de transportadores de membrana de tipo bombas de flujo, que disminuyen la concentración intracelular del fármaco (Noel T, 2012).
Tabla 1. Antifúngicos azólicos más comunes.
3.1 Mutaciones puntuales de ERG11
El gen Erg11p en Candida posee una longitud de aproximadamente 1589 pb y codifica para 595 aminoácidos. A la fecha han sido identificados más de 150 mutaciones puntuales para este gen, sin embargo, no todas ellas han sido asociadas a fenómenos de resistencia antibiótica (Morio et al., 2010). Las mutaciones en el gen Erg11p se agrupan en en regiones específicas de la secuencia de aminoácidos como lo son las regiones 105-165 aa, 266-287 aa y 405-488 aa. Estas regiones se caracterizan por ser dominios asociados a canales de membrana y fijación de grupos hemo. Se cree que dichas mutaciones impiden que la molécula antifúngica se asocie al receptor y disminuyen la afinidad global entre el fármaco y su receptor.
3.2 Sobreexpresión del gen ERG11
La regulación positiva del gen ErG11 ha sido asociada a la pérdida de susceptibilidad a los antifúngicos azoles. De acuerdo con los estudios realizados por Hoot et al., en 2011 y Marichal et al., 1997, aumentos entre 3 y 20 veces en la expresión del gen ERG11 están asociados a la resistencia antifúngica. Dicha sobreexpresión puede ser causada por la duplicación del gen ERG11 o la regulación de la vía de biosíntesis del Ergosterol. Adicionalmente, han sido identificados los factores de transcripción UPC2p y Ecm22p, los cuales se ubican en promotores de diferentes genes ERG, activando la transcripción del gen. La expresión del gen UPC2p se induce en presencia de fármacos antifúngicos incluido el fluconazol y aumenta la expresión de los genes ERG2 y ERG11 cuando Candida albicans crece en presencia del fármaco azólico (Silver et al., 2004). Es posible que la disminución del contenido de Ergosterol actúe como señal para activar la sobreexpresión de ERG debido a UPC2p.
3.3 Sobreexpresión de genes codificantes para bombas de flujo.
Las bombas de flujo corresponden a una maquinaria molecular utilizada para transportar iones dentro y fuera de la célula, sin embargo, estas han adquirido una función dual que les permite, además, transportar sustancias exógenas, es decir, una bomba es capaz de expulsar un compuesto específico o compuestos estructuralmente diversos (Van Bambeke et al., 2003). Este mecanismo está presente tanto en eucariotas como en procariotas. Sin embargo, muestra un efecto fuerte en la resistencia intrínseca y adquirida, alcanzando cambios de varios órdenes de magnitud en la susceptibilidad a los fármacos atribuida a los transportadores trans-envolventes en los cuales el compuesto tóxico es capturado en el periplasma y directamente expulsado al medio externo (Nikaido, 2001).
A lo largo de los años, han sido identificados genes cuya sobreexpresión está asociada a resistencia a antifúngicos, especialmente a fluconazol, entre ellos se encuentran CDR1, CDR2, MDR1, MDR2 y FLU1. En un estudio realizado por Pourakbari y colaboradores en 2017, mediante PCR en tiempo real de transcripción reversa se midieron los niveles de los genes ya mencionados y se concluye que existe una relación entre la sobreexpresión de los genes CDR1, CDR2, MDR1 y MDR2 y la resistencia a fluconazol, sin embargo, la sobreexpresión del gen FLU1 parece no estar asociada a dicha resistencia.
4. Plasticidad genotípica de las especies de Candida y expresión génica.
El genoma de Candida es diploide y está distribuido en 8 cromosomas. Candida albicans exhibe una amplia plasticidad genómica que permite truncamientos y translocaciones de cromosomas probablemente mediada por recombinación mitótica. Algunos aislados clínicos de C. albicans resistentes al fluconazol presentan trisomía en el cromosoma 5, el cual a su vez presenta en su brazo p los genes ERG11 y TAC1, que codifican para el receptor de los azoles y el regulador de bombas de flujo tipo ABC. Se estima que al menos un tercio de las cepas resistentes al fluconazol presentan este tipo de aneuploidía (Selmecki et al., 2006). La duplicación de los genes ERG11 y TAC1 contribuye a la resistencia mediante sobreexpresión de genes.
Conclusión
Los hongos oportunistas de la especie Candida han sido asociados con un amplio espectro de infecciones humanas con tasas significativas de morbilidad y mortalidad, que van desde infecciones superficiales de la piel hasta candidiasis profundas o diseminadas con reportes de hasta 1 caso por cada 1000 pacientes ingresados. La terapia antifúngica para el tratamiento de la candidiasis está limitada al uso de cuatro clases principales de medicamentos antifúngicos, incluidos los azoles, polienos, fluoropirimidinas y equinocardinas, sin embargo, el uso indiscriminado de estos fármacos ha conllevado al desarrollo de mecanismos moleculares de resistencia que le permiten al patógeno expulsar el fármaco, inhibir su mecanismo de acción o metabolizarlo evadiendo así el efecto fungicida o fungistático. Entre los antifúngicos actuales, los azoles siguen siendo el tipo de antimicótico más usado ya que presentan un amplio espectro de actividad frente a levaduras, dermatofitos, hongos patógenos primarios y algunos hongos miceliares. Las levaduras del género Candida poseen como target de los azoles, la proteína Erg11p, la cual posee funciones relevantes para el metabolismo del hongo y el mantenimiento de la membrana citoplasmática como la biosíntesis del ergosterol. Los microorganismos del género Candida han desarrollado resistencia a los azoles mediante diversos mecanismos como mutaciones puntuales en el gen que codifica para la proteína target inhibiendo la adhesión del fármaco a su diana o disminuyendo su afinidad química hacia el fármaco, otros mecanismos asociados a la resistencia a los azoles son la sobreexpresión de genes de resistencia y producción de bombas de flujo capaces de eliminar el fármaco, además de la plasticidad genotípica que incluye la presencia de elementos transponibles o aneuploidías en cromosomas que poseen genes de resistencia aumentando así la expresión de los mismos. Lo anterior es un claro ejemplo de cómo la evolución permite la adaptación de los seres vivos a ambientes altamente agresivos.
En la actualidad se considera que uno de cada cuatro aislados de especies de Candida presentan algún tipo de resistencia a los fármacos, incluso en la actualidad son descubiertas nuevas especies como Candida auris, que desde su aparición en entornos clínicos ya presenta resistencia a los antifúngicos, este escenario conlleva a replantearse la necesidad de aumentar los recursos destinados a investigación tanto en nuevas moléculas antifúngicas como en el estudio de los mecanismos de acción que generan resistencia, así como factores de virulencia que facilitan la infección y colonización del huésped. Las ciencias ómicas representan una oportunidad para explorar genomas y transcriptomas completos tal que se puedan explorar los cambios a nivel genético y los procesos causantes de resistencia y que a su vez permitan el desarrollo de nuestras estrategias para enfrentar la resistencia.
References
El-Houssaini, H. H., Elnabawy, O. M., Nasser, H. A., & Elkhatib, W. F. (2019). Correlation between antifungal resistance and virulence factors in Candida albicans recovered from vaginal specimens. Microbial pathogenesis, 128, 13-19.
Girão, E., Levin, A. S., Basso, M., Gobara, S., Gomes, L. B., Medeiros, E. A. S., ... & Costa, S. F. (2008). Trends and outcome of 1121 nosocomial bloodstream infections in intensive care units in a Brazilian hospital, 1999–2003. International Journal of Infectious Diseases, 12(6), e145-e146.
Hoot, S. J., Smith, A. R., Brown, R. P., & White, T. C. (2011). An A643V amino acid substitution in Upc2p contributes to azole resistance in well-characterized clinical isolates of Candida albicans. Antimicrobial agents and chemotherapy, 55(2), 940-942.
Kelly, S. L., Lamb, D. C., Corran, A. J., Baldwin, B. C., & Kelly, D. E. (1995). Mode of action and resistance to azole antifungals associated with the formation of 14α-methylergosta-8, 24 (28)-dien-3β, 6α-diol. Biochemical and biophysical research communications, 207(3), 910-915.
Kohli, A., Smriti, N. F. N., Mukhopadhyay, K., Rattan, A., & Prasad, R. (2002). In vitro low-level resistance to azoles in Candida albicans is associated with changes in membrane lipid fluidity and asymmetry. Antimicrobial agents and chemotherapy, 46(4), 1046-1052.
Marichal, P., Bossche, H. V., Odds, F. C., Nobels, G., Warnock, D. W., Timmerman, V., ... & Mose-Larsen, P. (1997). Molecular biological characterization of an azole-resistant Candida glabrata isolate. Antimicrobial Agents and Chemotherapy, 41(10), 2229-2237.
Morio, F., Loge, C., Besse, B., Hennequin, C., & Le Pape, P. (2010). Screening for amino acid substitutions in the Candida albicans Erg11 protein of azole-susceptible and azole-resistant clinical isolates: new substitutions and a review of the literature. Diagnostic microbiology and infectious disease, 66(4), 373-384.
Mukhopadhyay, K., Prasad, T., Saini, P., Pucadyil, T. J., Chattopadhyay, A., & Prasad, R. (2004). Membrane sphingolipid-ergosterol interactions are important determinants of multidrug resistance in Candida albicans. Antimicrobial Agents and Chemotherapy, 48(5), 1778-1787.
Nikaido, Evolutionary origins of multidrug and drug-specific efflux pumps in bacteria, FASEB J. 12 (1998) 265–274.
Noël, T. (2012). The cellular and molecular defense mechanisms of the Candida yeasts against azole antifungal drugs. Journal de mycologie medicale, 22(2), 173-178.
Pourakbari, B., Teymuri, M., Mahmoudi, S., K Valian, S., Movahedi, Z., Eshaghi, H., & Mamishi, S. (2017). Expression of Major Efflux Pumps in Fluconazole-Resistant Candida albicans. Infectious Disorders-Drug Targets (Formerly Current Drug Targets-Infectious Disorders), 17(3), 178-184.
Selmecki, A., Forche, A., & Berman, J. (2006). Aneuploidy and isochromosome formation in drug-resistant Candida albicans. Science, 313(5785), 367-370.
Silva, S., Negri, M., Henriques, M., Oliveira, R., Williams, D. W., & Azeredo, J. (2012). Candida glabrata, Candida parapsilosis and Candida tropicalis: biology, epidemiology, pathogenicity and antifungal resistance. FEMS microbiology reviews, 36(2), 288-305.
Silver, P. M., Oliver, B. G., & White, T. C. (2004). Role of Candida albicans transcription factor Upc2p in drug resistance and sterol metabolism. Eukaryotic Cell, 3(6), 1391-1397.
Van Bambeke F, Glupczynski Y, Plesiat P, Pechere JC, Tulkens PM. Antibiotic efflux pumps in prokaryotic cells: occurrence, impact on resistance and strategies for the future of antimicrobial therapy. J Antimicrob Chemother 2003;51:1055–65.
White, T. C. (1997). Increased mRNA levels of ERG16, CDR, and MDR1 correlate with increases in azole resistance in Candida albicans isolates from a patient infected with human immunodeficiency virus. Antimicrobial agents and chemotherapy, 41(7), 1482-1487.
Wille, M. P., Guimarães, T., Furtado, G. H. C., & Colombo, A. L. (2013). Historical trends in the epidemiology of candidaemia: analysis of an 11-year period in a tertiary care hospital in Brazil. Memorias do Instituto Oswaldo Cruz, 108(3), 288-292.
Wirsching, S., Michel, S., & Morschhäuser, J. (2000). Targeted gene disruption in Candida albicans wild‐type strains: the role of the MDR1 gene in fluconazole resistance of clinical Candida albicans isolates. Molecular microbiology, 36(4), 856-865.
Yapar, N., Pullukcu, H., Avkan-Oguz, V., Sayin-Kutlu, S., Ertugrul, B., Sacar, S., ... & Kaya, O. (2011). Evaluation of species distribution and risk factors of candidemia: a multicenter case-control study. Medical mycology, 49(1), 26-31.
Document information
Published on 08/06/19
Submitted on 31/05/19
Licence: CC BY-NC-SA license