Resumen
Se presenta un modelo matemático de la marcha del amputado transtibial a partir del modelo de péndulo invertido para mostrar la afectación de esta al variar los componentes de la prótesis. El modelo para la extremidad inferior con amputación transtibial es un péndulo triple con 6 segmentos y 7 grados de libertad, se utilizó la teoría de Lagrange para determinar las ecuaciones de movimiento del sistema. Teniendo las ecuaciones del sistema se diseñó un software de simulación para visualizar la animación en 3D del paciente en marcha normal y con prótesis, además del análisis cinemático en las articulaciones de la extremidad inferior y las fuerzas que se aplican sobre las superficies. También se adquieren datos espacio-temporales propios de la marcha y es posible variar el peso y altura del paciente, así como longitudes, diámetros y materiales de los componentes de la prótesis, haciendo posible realizar el análisis para distintos sujetos.
Palabras clave: Amputación, modelado, rehabilitación, sistema software
Abstract
A mathematical model of the gait of the transtibial amputee based on the inverted pendulum model is presented, this model shows the gait affectation when the prosthesis components vary. The model for the lower limb with transtibial amputation is a triple pendulum with 6 segments and 7 degrees of freedom, the Lagrange theory to determine the equations of motion of the system was used. With the system's equations, simulation software to visualize the 3D animation of the patient in normal gait and with prosthesis was designed, also to kinematic analysis of the joints of the lower limb and the forces applied to the surfaces. Spatio-temporal data specific to gait are acquired and it is possible to vary the weight and height of the patient, lengths, diameters and materials of the prosthesis components, making it possible to carry out the analysis for different subjects.
Keywords: Amputation, modeling, rehabilitation, software system
1. Introducción
La marcha o caminata es de las funciones indispensables en el mantenimiento de las actividades físicas de todas las personas, ayuda a controlar la morbilidad, dependencia física y emocional y la mortalidad; la afectación de la marcha se produce por diversas causas lo que lleva a deteriorar la calidad de vida y al declive funcional, además de incrementar el gasto sanitario y asistencial [1].
La marcha humana se produce como resultado de la sincronización de los movimientos de los miembros inferiores del cuerpo, intervienen el sistema muscular y nervioso, por ello su análisis se convierte en una tarea compleja [2]. La biomecánica, las herramientas computacionales, el estudio electromiográfico y los estudios dinámicos, son los enfoques utilizados actualmente para construir modelos aproximados del comportamiento de la caminata humana [3,4,5]. Así se obtiene información cinemática como velocidad, aceleración y desplazamiento del cuerpo humano durante la marcha. Los enfoques para el modelado de la marcha se usan en aplicaciones médicas, rehabilitación, diseño de prótesis y órtesis y aplicaciones robóticas. Con los modelos se pueden conocer los factores determinantes en el deterior de la marcha para así realizar correctivos que permita mantener la movilidad con bajo gasto energético [1]. Hay dos clases de enfoques en el estudio de la marcha: 1) Los modelos analíticos y análisis y 2) los métodos estadísticos [3,6].
Al reemplazar el miembro perdido con una prótesis, el principal inconveniente es el aumento del consumo energético durante la caminata. Muchos trabajos sugieren que modificaciones en la alineación de la prótesis son determinantes en la disminución en el costo energético [7,8]. Otro factor influyente es el tipo de pie, por ello muchas de las prótesis transtibiales tienen pies con la capacidad de almacenar energía [9,10].
Con la aparición de herramientas de simulación, el diseño y la evaluación de prótesis se ha visto impactada. Se pueden implementar modelos de marcha para obtener información acerca de la dinámica. La herramienta Opensim es un software libre desarrollado por la Universidad de Stanford [11], permite modelar las condiciones de un individuo, pero no realizar consideraciones generales para una patología de estudio.
Para determinar la cinemática como consecuencia de las fuerzas y momentos aplicadas entre segmentos, los modelos de dinámica directa proceden de la integración de las ecuaciones de movimiento de un cuerpo rígido durante un período de tiempo, con unas condiciones iniciales [12,13,14]. Dado que la medición de estas fuerzas y momentos in vivo es difícil y hay una falta de algoritmos de control suficientes para especificar estas cantidades, los modelos de dinámica directa utilizan estrategias de anticipación [14,15]. Los modelos dinámicos directos pueden ser herramientas poderosas para la predicción, pero cuando se toman estrategias de lazo abierto, pequeños errores en los momentos de las articulaciones resultan en la acumulación de errores cinemáticos, razón por la cual pueden predecir incorrectamente la estabilidad del sistema [2,15,16].
Por lo tanto, es necesario la creación y desarrollo de herramientas que aporten en las mediciones y en simulaciones para evaluar diferentes parámetros de la locomoción bípeda. Existen softwares que simulan la marcha humana con mediciones realizadas por visión artificial o análisis vectorial, pero muy pocos permiten la modificación de parámetros como fuerzas, longitudes y pesos.
El proceso que se lleva a cabo para determinar la prótesis de un paciente es netamente empírico, ya que el paciente debe manifestar las incomodidades que presenta con el uso de esta y así efectuar los cambios en las prótesis para asegurar la comodidad del paciente y efectividad del movimiento [17]. Teniendo una simulación con los parámetros físicos de las extremidades inferiores sería más confiable la asignación de la prótesis ya que se elegiría dependiendo del análisis teórico basado en la simulación.
Se implementó un software capaz de mostrar cómo afecta la prótesis en la marcha del paciente al variar las dimensiones de los componentes y así tener bases que permitan caracterizar la prótesis. Para llevar a cabo esta investigación fue indispensable el análisis cinemático y dinámico de la marcha con 5 segmentos: cadera, fémur derecho, fémur izquierdo, tibia derecha y tibia izquierda. Se dedujo la ecuación de movimiento que describe este proceso y se implementó en la simulación permitiendo la variación de parámetros tales como: longitud de las extremidades, peso de cada segmento, características de la prótesis, su longitud, peso, ángulos de alineación y puntos de apoyo. El análisis se realiza en el plano sagital con coordenadas cartesianas. El desarrollo del modelo se realiza por medio de la aproximación de péndulos (doble y triple) ya que representan la marcha de la forma más fiel posible sin la necesidad de datos experimentales.
2. Metodología
2.1. Modelo matemático
Teniendo en cuenta que el movimiento de las piernas del ser humano se asemeja con la dinámica de un péndulo doble, se aproximó la ecuación de movimiento de dicho péndulo para adaptarlo a la marcha humana y representarla como simulación.
Para una pierna amputada y que usa la prótesis transtibial, se puede aproximar al modelo de un péndulo triple, siendo el muslo, el muñón y la prótesis los tres eslabones correspondientes a este modelo. La pierna no amputada se modelo como péndulo doble.
2.1.1. Modelo péndulo doble
Se empleo la teoría de Lagrange basada en el cálculo de energías y tomando la pierna con las características que se presentan en la Figura 1.
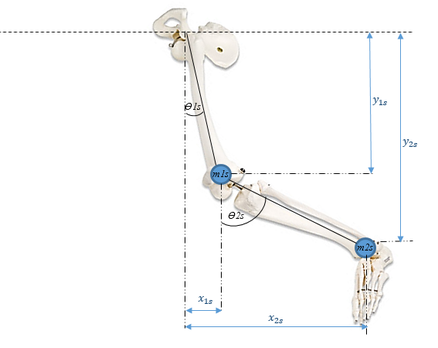
|
| Figura 1. Modelo péndulo doble |
Se aproxima la pierna a un péndulo doble, con masas y longitudes dadas por los pesos y alturas de cada segmento de la pierna. A partir de la Figura 1, se establecen las ecuaciones. y corresponden a la longitud del fémur y la tibia, respectivamente.
- m1s (Muslo de Pierna no amputada):
Ecuaciones de posición:
|
|
(1) |
|
|
(2) |
Componentes de velocidad:
|
|
(3) |
|
|
(4) |
Velocidad Total:
|
|
(5) |
Energía Cinética
|
|
(6) |
Energía Potencial
|
|
(7) |
- m2s (Pantorrilla de Pierna no amputada):
Ecuaciones de posición:
|
|
(8) |
|
|
(9) |
Velocidad total:
|
|
(10) |
|
|
(11) |
Energía Cinética:
|
|
(12) |
Energía Potencial:
|
|
(13) |
Energía cinética total:
|
|
(14) |
Energía potencial total:
|
|
(15) |
Ángulo de abertura respecto a la vertical del fémur empleando Lagrange:
|
|
(16) |
Ángulo de abertura respecto a la vertical de la tibia empleando Lagrange:
|
|
(17) |
El movimiento de la tibia de la pierna no amputada se obtiene con la integración de los valores de aceleración y velocidad angular para el ángulo . A partir de allí se realiza el subsistema de retroalimentación de variables de las ecuaciones de movimiento para y , teniendo todo el movimiento de la pierna no amputada.
2.1.2. Modelo péndulo triple.
La pierna amputada con prótesis se trató como un péndulo triple (Figura 2). Las masas y longitudes están dadas por los pesos y alturas de la prótesis, el muñón y el muslo.
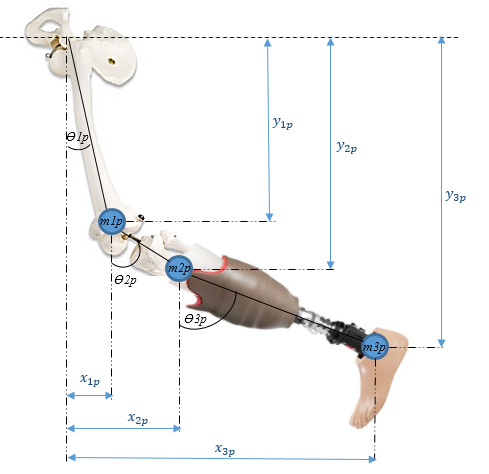
|
| Figura 2. Modelo Péndulo Triple |
- m1p (Muslo de pierna amputada):
Posición:
|
|
(18) |
|
|
(19) |
Velocidad total:
|
|
(20) |
Energía Cinética:
|
|
(21) |
Energía potencial:
|
|
(22) |
- m2p (Muñón):
Posición:
|
|
(23) |
|
|
(24) |
Velocidad:
|
|
(25) |
|
|
(26) |
Velocidad total:
|
|
(27) |
Energía Cinética:
|
|
(28) |
Energía Cinética total:
|
|
(29) |
Energía Potencial total:
|
|
(30) |
- m3p (Prótesis):
Posición:
|
|
(31) |
|
|
(32) |
Velocidad:
|
|
(33) |
|
|
(34) |
Velocidad total:
|
|
(35) |
Energía Cinética:
|
|
(36) |
Energía Potencial:
|
|
(37) |
Energía Cinética total:
|
|
(38) |
Energía Potencial total:
|
|
(39) |
Ecuaciones de movimiento:
|
|
(40) |
|
|
(41) |
|
|
(42) |
El movimiento de la pierna amputada se obtiene a partir del movimiento de la prótesis, ángulo . Luego se conectan todas las retroalimentaciones necesarias para las ecuaciones de movimiento de toda la pierna amputada.
Se tienen dos subsistemas: pierna no amputada y pierna amputada (Figura 3).
|
| Figura 3. Sistema General de las dos extremidades |
2.2. Diseño de la interfaz gráfica de usuario
Con el fin de obtener los datos iniciales para el funcionamiento del modelo y del software se diseñó una interfaz gráfica, allí se ingresan los parámetros: masa corporal, altura del paciente y tipo de material de la prótesis. A partir de estos datos se calculan y visualizan las características del paciente estudiado, las mediciones de fuerzas, energías y parámetros espaciotemporales tanto de la marcha sana, como de la protésica.
3. Resultados
Se obtuvo una herramienta computacional para mostrar las características de una marcha protésica. El funcionamiento de los modelos desarrollados se observa al ejecutar un análisis con un paciente de las siguientes características: Altura: 1,604 m y Masa corporal: 60,16 Kg. En la Figura 4 se muestra la representación en 3D del sujeto.
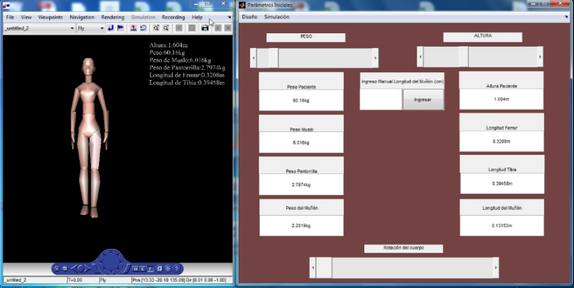
|
| Figura 4. Configuración inicial del sistema |
Con el peso y la altura del paciente se establecen los parámetros de la prótesis: longitud, peso y material [18,19]. El resultado de la marcha tanto protésica como normal se muestra en 3D (Figura 5).
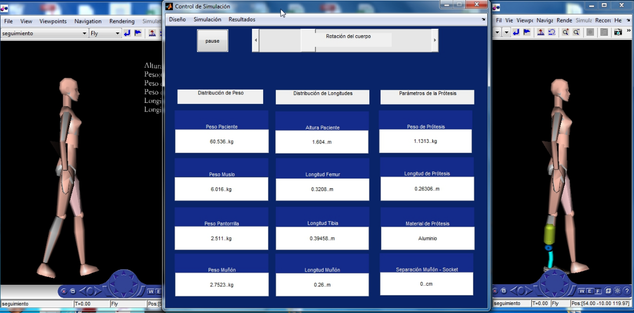
|
| Figura 5. Simulación Gráfica de la marcha normal y con prótesis |
El reporte del análisis de la marcha en cuanto a “Energía, Velocidad y Fuerzas”, “Ángulos” y “Lista de parámetros”, da a conocer los parámetros cinéticos y espaciotemporales analizados en la simulación, tanto para la marcha sana, como para la marcha protésica. Cada parámetro se presenta en un mismo eje para ver fácilmente las diferencias existentes entre cada tipo de marcha, identificadas por una etiqueta y un color, (Figura 6).
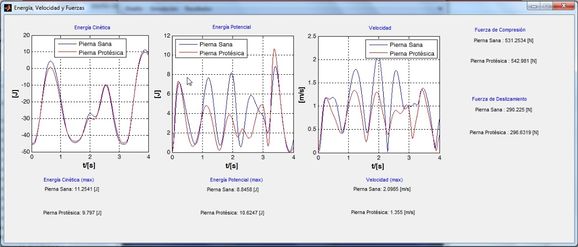
|
| (a) Gráficos comparativos de energías |
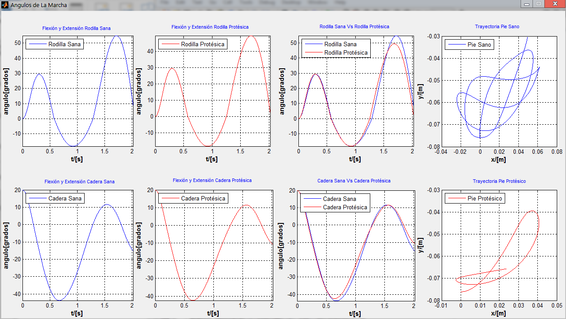
|
| (b) Gráficos de los ángulos |
| Figura 6. Gráficos de los parámetros calculados en la marcha. En azul para la marcha no amputada y rojo para la marcha protésica |
4. Conclusiones
La aplicación realizada es una gran herramienta para obtener resultados acerca del movimiento de la marcha ya que se basa en un modelo netamente matemático con datos obtenidos experimentalmente. Este sistema permite mostrar la afectación en la marcha del amputado al variar los componentes de la prótesis, esto ayudará al personal especializado entender la importancia de la ubicación de los componentes de forma objetiva.
Al observar las curvas generadas por la simulación de los modelos en el mismo plano se aprecia las diferencias en la respuesta de ambas piernas, al final de las fases de balanceo y apoyo, donde los valores de los ángulos de la pierna protésica son menores a los valores de la pierna sana.
El tiempo de fase de soporte es mayor al tiempo en fase de balanceo en la pierna protésica, el ciclo de marcha tiende a disminuir, lo que sumado a la disminución de la longitud de paso, genera una reducción en la velocidad de la marcha del paciente amputado. El paciente tiende a soportar la pierna amputada el menor tiempo posible en comparación con la no amputada. El tiempo de la fase de balanceo en la pierna protésica es mayor al tiempo empleado en la misma fase de la pierna sana.
El paciente se apoya más sobre su pierna no amputada, de esta manera la energía consumida por esta pierna es mayor que la amputada, el paciente intenta compensar la función que llevaba a cabo su pierna faltante.
La fuerza ejercida por el pie protésico en cada paso es menor a la del pie sano, debido a que en conjunto el peso de la extremidad protésica es inferior al de la pierna sana. Al modificar el peso de la prótesis para ser mayor, la fuerza tiende a aumentar y puede superar la presente en el pie sano.
Permitir que exista una distancia considerable entre el muñón y el socket, careciendo de un ajuste óptimo, genera variaciones poco favorables para la marcha, entre ellas la acumulación excesiva de energía no consumida sobre la pierna amputada, el aumento de la longitud del paso, disminución considerable en los tiempos de cada fase de la marcha, que descompensan los parámetros característicos, y en general tiende a desestabilizar la marcha respecto a los valores normales.
Referencias
[1] Leirós-Rodríguez R., Romo-Pérez V., Arce-Fariña M. E., García-Soidán J.L. Relación entre composición corporal y movimientos realizados durante la marcha en mujeres. Rev. Int. Med. Cienc. Act. Fís. Deporte, 18(72):693–707, 2018. http://dx.doi.org/10.15366/rimcafd2018.72.006
[2] Winter D.A. Biomechanics and motor control of human movement. Vol 4, John Wiley & Sons Inc, New Jersey, septiembre 2009. https://doi.org/10.1002/9780470549148
[3] Contreras Bravo L.E., Tristancho Ortiz J.A., Vargas Tamayo L.F. Análisis biomecánico de marcha humana a través de técnicas de modelaje. Entre Cienc. e Ing., 6(12):29-35, 2012.
[4] Collado Vázquez S. Análisis de la marcha humana con plataformas dinamométricas. Influencia del transporte de carga. Universidad Complutense de Madrid, 2002.
[5] Contreras Bravo L.E., Roa Garzón M.A. Modelamiento de la marcha humana por medio de gráficos de unión. Con-Ciencias, 16:26–42, 2005.
[6] Cifuentes C., Martínez F., Romero E. Análise teórica e computacional do marcha normal e patológico: uma revisão. Rev. Med, 18(2):182–196, 2010.
[7] Winarski D.J., Pearson J.R. Perturbation of prosthesis alignment and its effect on below-knee amputees. Proceedings of the Sixth New England Bioengineering Conference, 6:149–152, 1978. https://doi.org/10.1016/B978-0-08-022678-1.50043-6
[8] Luengas C.L.A., Camargo E., Guardiola D. Modeling and simulation of prosthetic gait using a 3-D model of transtibial prosthesis. Rev. Ciencias la Salud, 16(1):82–100, 2018. https://doi.org/http://dx.doi.org/10.12804/revistas.urosario.edu.co/revsalud/a.6492
[9] Sawers A., Hahn M.E. Trajectory of the center of rotation in non-articulated energy storage and return prosthetic feet. J. Biomech., 44(9):1673–1677, 2011. https://doi.org/10.1016/j.jbiomech.2011.03.028
[10] Fey N.P., Klute G.K., Neptune R.R. Altering prosthetic foot stiffness influences foot and muscle function during below-knee amputee walking : A modeling and simulation analysis. J. Biomech., 46(4):637–644, 2013. https://doi.org/10.1016/j.jbiomech.2012.11.051
[11] Delp S.L. et al. OpenSim: open-source software to create and analyze dynamic simulations of movement. IEEE Trans. Biomed. Eng., 54(11):1940–1950, 2007. https://doi.org/10.1109/TBME.2007.901024
[12] Ventura J.D., Segal A.D., Klute G.K., Neptune R.R. Compensatory mechanisms of transtibial amputees during circular turning. Gait Posture, 34(3):307-312, 2011. https://doi.org/10.1016/j.gaitpost.2011.05.014
[13] Taga G., Yamaguehi Y., Shimizu H. Self-organized control of bipedal locomotion by neural oscillators in unpredictable environment. Biol. Cybern., 65:147–159, 1991. https://doi.org/10.1007/bf00198086
[14] De Pina C. Humanoid robots: new developments. IntechOpen, Croatia, 2007. https://doi.org/10.5772/39
[15] Srinivasan S. Low-dimensional modeling and analysis of human gait with application to the gait of transtibial prosthesis users. Ohio State University, 2007.
[16] Dumas R., Cheze L. Hip and knee joints are more stabilized than driven during the stance phase of gait: an analysis of the 3D angle between joint moment and joint angular velocity. Gait Posture, 28(2):243-50, 2008. https://doi.org/10.1016/j.gaitpost.2007.12.003
[17] Luengas C.L.A., Gutierrez M.A., Camargo E. Alineación de prótesis y parámetros biomecánicos de pacientes amputados transtibiales. UD Editorial, Bogotá, Colombia, 2017.
[18] Ardila J.C., Scarpetta J.M. Modelo matemático y herramienta de simulación de exoesqueleto activo de cinco segmentos. Revista Científica Guillermo Ockham, 10(2):93–105, 2012.
[19] Garcia V., Garcia M., Hernandez K. Diseño de prótesis mioeléctrica. Instituto Politecnico Nacional Esime Azcapotzalco, Mexico, 2004.
Document information
Published on 05/10/20
Accepted on 28/09/20
Submitted on 05/04/20
Volume 36, Issue 4, 2020
DOI: 10.23967/j.rimni.2020.10.001
Licence: CC BY-NC-SA license
Share this document
Keywords
claim authorship
Are you one of the authors of this document?