Resumen
La nicotina es el ingrediente psicoactivo del tabaco y se ha descrito como aversiva, reforzante o procognitiva. Sin embargo no existe mucha investigación sobre el sobrelapamiento de los efectos dosis-dependientes como estímulo aversivo y procognitiva. Por lo que evaluaremos los efectos de la nicotina en el paradigma de condicionamiento aversivo al sabor (CAS), con el objetivo de obtener una curva dosis-respuesta del efecto aversivo y compararlo con los efectos procognitivos reportados. Se utilizaron 20 ratas macho Wistar asignadas aleatoriamente a cinco grupos (0.0, 0.2, 0.4, 0.8 y 1.6 mg/kg i.p.). Los resultados muestran tendencia al decremento dosis-dependiente con efecto máximo en la dosis de 1.6 mg/kg, sin embargo se hallaron efectos a partir de la dosis de 0.8 mg/kg lo cual sobrelapa con las dosis propuestas con efectos procognitivos. Esto nos permite proponer que algunos efectos puedan deberse a efectos aversivos periféricos más que a centrales.
Abstract
Nicotine is the main ingredient of tobacco and it has been described as aversive, reinforce and procognitive. However there is not enough research about the overlapping of the dose-dependent effects as aversive stimulus and precognitive effects. For those reasons we evaluated the nicotine effects on the Conditioned Taste Aversion paradigm (CTA) to measure the dose-response curve of the aversive effects of nicotine and to compare such effects with the procognitive effects reported. 20 male Wistar rats in standard laboratory conditions were randomly assigned to 5 groups (0.0, 0.2, 0.4, 0.8 y 1.6 mg/kg i.p.). The obtained results showed a dose-dependent decrease with a maximum effect at 1.6 mg/kg dose; however we founded effects from the 0.8 mg/kg dose, such dose overlapped with procognitive doses reported. These results allow us to propose that some effects could be due the periferical aversive effects instead of the central procognitive effects.
Palabras clave
CAS ; Nicotina ; Sacarina ; Neofobia ; EC ; EI
Keywords
CTA ; Nicotine ; Saccharin ; CS ; US
Cualquier animal humano o no humano debe ser capaz de enfrentarse exitosamente a los cambios ambientales para sobrevivir. Así, el aprendizaje se ofrece como una de las herramientas más importantes para adaptarse a los cambios. El Condicionamiento Aversivo al Sabor (CAS) es un tipo de condicionamiento en el cual un sabor novedoso se parea con un malestar gastrointestinalinducido por la administración de otra sustancia, generalmente cloruro de litio (LiCl), trayendo como resultado el organismo decrementa el consumo del sabor novedoso (Molero, 2007 ).
El paradigma exhibe ciertas características que lo dotan de alta relevancia biológica y adaptativa para el organismo, la principal de ellas es que, mientras en otros tipos de condicionamiento, el aprendizaje es el reflejo de muchos ensayos para que se dé un correcto pareamiento entre los estímulos, la respuesta de asociación entre el Estímulo Condicionado (EC) y el Estímulo Incondicionado (EI) en el paradigma de CAS frecuentemente puede ser aprendida en un único ensayo (Loy & Hall, 2002 ). Esto tiene un alto sentido evolutivo al incrementar la probabilidad de sobrevivencia del organismo, ya que a pesar de que la ingesta de alimentos y líquidos es de suma importancia, la ingestión de ciertos elementos puede matarlo o hacerlo vulnerable a un ataque o enfermedad, de modo que tener mecanismos de aprendizaje que respondan a una única exposición puede ser la diferencia entre conservar la vida o morir (Chance, 2001 ).
En cuanto a los sustratos neurales de este tipo de condicionamiento, se ha relacionado a la Corteza Insular con la producción de una señal gustativa (Molero, 2007 ) al generar una representación mnésica del sabor, así mismo se ha demostrado que las funciones de adquisición y consolidación del CAS dependen esencialmente de esta estructura (Bermúdez-Rattoni & McGaugh, 2004; Bures, Bermudez-Rattoni & Yammoto 1998 ; Welzl, Adamo & Lipp, 2001 ). La Corteza Insular también se ha involucrado en la novedad del estímulo del sabor (Roman, Lin & Reilly, 2010 ) ya que se ha demostrado que las lesiones en ella impiden el reconocimiento de la neofobia, atenuando el consumo del sabor novedoso (Roman et al., 2010 ).
Por otra parte la Amígdala ha sido implicada en la alteración de la adquisición de las aversiones gustativas (Molero, 2007 ), de manera especial se ha planteado la participación de la amigada basolateral en los procesos de modulación de la consolidación (Miranda & McGaugh, 2004 ) y otorga saliencia emocional a los estímulos sensoriales a los que se enfrentará el organismo (Aggleton & Mishkin, 1986 ), ya que se ha observado que al parear el EC con el EI la Amígdala Basolateral se activa (Koh & Bernstein, 2005 ). Finalmente, se ha reportado que la integridad del sistema colinérgico es fundamental ya que la destrucción de las proyecciones hacía la neocorteza traen como resultado deficiencias en el aprendizaje y la memoria en tareas de CAS (Wilkins, 2009 ).
En la mayoría de los experimentos de CAS, el malestar gastrointestinal asociado al EC es causado por la administración de LiCl, sin embargo, se ha reportado que una gran cantidad de drogas presentan propiedades aversivas. Esta característica de las drogas podría dificultar la interpretación de resultados dada la interferencia de este tipo de aprendizaje con los efectos centrales buscados. Por esta razón, en esta investigación decidimos usar nicotina como EI para evaluar si la aversión producida por la administración periférica de nicotina (intraperitoneal, ip), se sobrelapa con las dosis observadas con efecto central.
La nicotina es el componente psicoactivo del tabaco que puede actuar como una droga con efectos reforzantes y aversivos, esto debido a los centros principales en donde actúa (Rinker et al., 2008 ), así como las condiciones experimentales (Ciobica, Padurariu & Hritcu, 2012 ; Rushforth, Steckler & Shoaib, 2011 ).
Aunado a lo anterior, experimentos realizados con agonistas y antagonistas nicotínicos, sustentan la hipótesis de que tanto las propiedades reforzantes como las propiedades aversivas de la nicotina son mediadas por receptores colinérgicos, se ha propuesto principalmente la participación de los receptores α4β2 (Shoaib, Gommans, Morley & Stolerman, 2002 ).
Los receptores nicotínicos se encuentran ampliamente distribuidos dentro del Sistema Nervioso Periférico (SNP) y Central (SNC). Los receptores nicotínicos del SNP se encuentran ubicados postsinapticamente, mediando respuestas excitadoras. Mientras que en el SNC los receptores nicotínicos se localizan preferentemente en las neuronas presinápticas, modulando la liberación de neurotransmisores como la dopamina, la serotonina, el ácido gama-aminobutírico, la noradrenalina y el glutamato (López & García, 2003 ). Sin embargo, cada subtipo de receptor nicotínico presenta una distribución regional, celular y subcelular distinta. En el SNC, entre las estructuras moduladas por efectos nicotínicos se encuentran el Sistema Mesolímbico Dopaminérgico y el Locus Coeruleus. El Sistema Mesolímbico Dopaminérgico se encarga de las funciones como placer, gratificación y reforzamiento, efecto posiblemente mediado por los receptores α4β2 y α4α6β2 en el Área Ventral Tegmental (AVT). Las áreas dopaminérgicas mesencefálicas reciben aferencias de inervaciones colinérgicas desde el Nervio Tegmental Pedunculopontino (PPT) y Tegmental Laterodorsal (LDT) (Dani, Jensn, Broussard & De Biasi, 2012 ). Por su parte el Locus Coeruleus está encargado del estado de alerta y vigilia del organismo y su estimulación incrementa la eficiencia de algunas funciones cognitivas, por ejemplo, el aprendizaje, la atención y la memoria (López & García, 2003 ).
Sin embargo, aunque la nicotina es una droga comúnmente estudiada en diversas tareas o procesos, no hay mucha investigación sobre el uso de la misma como estímulo aversivo (Garcha, Kumar, Pratt & Stolerman, 1982 en Kumar, Pratt & Stolerman, 1983 ;Kumar, Pratt & Stolerman, 1983 ; Shoaib, Gommans, Morley, Stolerman, Grailhe & Changeux, 2002 ) y no se ha evaluado profundamente el sobrelapamiento de los efectos aversivos con los efectos procognitivos reportados.
Por lo anterior, el objetivo principal del presente estudio es el de evaluar las propiedades aversivas de la nicotina en dosis reportadas como con efectos procognitivos.
Material y Método
Sujetos
Se utilizaron 20 ratas macho de la cepa Wistar, de 3 meses de edad y con un peso aproximado de 300–350 g al inicio del experimento. Los sujetos fueron alojados en cajas individuales de policarbonato, bajo condiciones estándar de laboratorio: temperatura, humedad y ciclos de luz-oscuridad controlados. Tenían alimento libre y acceso a agua por un periodo de 60 minutos cada día a la misma hora. Todo el experimento se llevó a cabo bajo la Norma Oficial Mexicana (NOM-062) para el cuidado y uso de los animales de laboratorio, y de los estándares del departamento de Psicobiología y Neurociencias de la Facultad de Psicología de la UNAM, para el uso y manejo de animales de laboratorio.
Drogas
Nicotina (Sigma Aldrich, St Louis MO.) diluida en solución isotónica salina al 0.9 % administrada en dosis de 0.0, 0.2, 0.4, 0.8 y 1.6 mg/kg por vía ip. en un volumende1 ml/kg.
Procedimiento CAS
Se cuantificó el consumo basal de agua de los sujetos. Posteriormente los sujetos tuvieron una sesión de pre-exposición a la solución de sacarina al 10% durante una hora para evitar la neofobia.
Todos los sujetos fueron asignados aleatoriamente a un total de 5 grupos (n=4), las dosis de nicotina fueron las siguientes: 0.2, 0.4, 0.8, 1.6 mg/kg y un grupo control (0.0 mg/kg) inyectado con solución isotónica salina (0.9 %) todas las dosis fueron inyectadas ip. en un volumen de 1.0 ml/kg.
Una vez asignados los grupos, se llevó a cabo el procedimiento de CAS, en el cual los sujetos tuvieron libre acceso a 100 ml de solución de sacarina por 30 minutos. Inmediatamente después, los sujetos recibieron la administración de nicotina dependiendo del grupo al cual pertenecían. Este procedimiento fue repetido por cuatro sesiones consecutivas para observar la curva de aprendizaje para cada una de las dosis.
Después de completar las 4 sesiones de administración de droga se llevó a cabo la prueba de dos botellas, la cual consistió en el libre acceso simultáneo a dos botellas: una con 100 ml de agua y otra con 100 ml de solución de sacarina por 30 minutos.
Análisis estadístico
Los datos obtenidos fueron el consumo en mililitros para cada una de las condiciones experimentales. Se realizó un ANOVA de dos vías de medidas repetidas (sesión X dosis de nicotina) para el desarrollo de la aversión por dosis. Para la prueba de dos botellas se utilizó la fórmula:
|
|
Donde A es el consumo de sacarina y B es el consumo de agua (Miranda, Cedillo-Ildefonso, Jiménez, Bedolla-Núñez & Torres-Rodríguez, 2011 ), este índice nos indica que un valor de 1.0 muestra preferencia por la solución de sacarina, mientras que un valor de 0.0 indica aversión. Estos índices fueron evaluados con un ANOVA de una vía para grupos independientes. De hallar resultados estadísticamente significativos se realizó un análisis a posteriori con el test de Tukey. Finalmente, para todos los análisis, el nivel de rechazo del error tipo I fue de p < 0.05. Para la elaboración del análisis datos se usó el programa SPSS versión 20, mientras que para la realización de las gráficas, se utilizó el software Sigma Plot versión 11.0.
Resultados
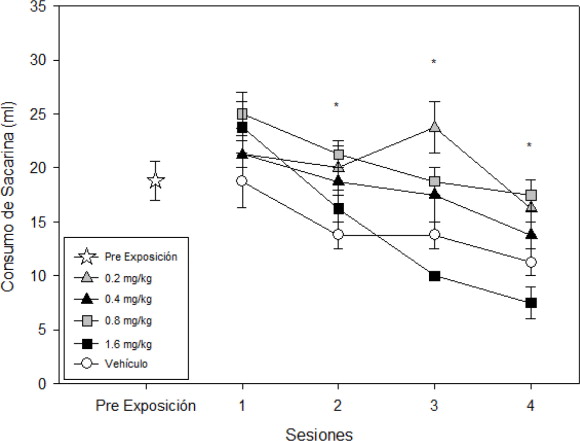
El ANOVA de dos vías arrojo resultados estadísticamente significativos para la interacción dosis x sesión (F [12,80]=2,423; p < 0.05). Se encontró que las diferentes dosis producen un efecto estadísticamente significativo (F [4,80]=13,023; p < 0.001), siendo las dosis de 0.2, 0.4 y 1.6 mg/kg las que arrojaron diferencias al compararlas contra el grupo control. Con lo que respecta a las sesiones se encontraron diferencias significativas (F [3,80]=22,764; p < 0.001) y su pudo observar que desde la segunda sesión se encontraron diferencias con respecto a la primera exposición a la nicotina (p<0.01) (ver Figura 1 ).
|
|
|
Figura 1. Relación temporal del consumo de sacarina de acuerdo al grupo, se presenta el desempeño en cuanto al consumo de sacarina en mililitros para los grupos nicotina y vehículo, además del nivel de consumo perteneciente al día de pre exposición de sacarina. Se observa que a medida que transcurren las sesiones, el consumo de sacarina decrementa en todos los grupos de nicotina siendo más acentuada con la dosis de 1.6 mg/kg. * indica diferencias significativas en el consumo de sacarina p < 0.05. |
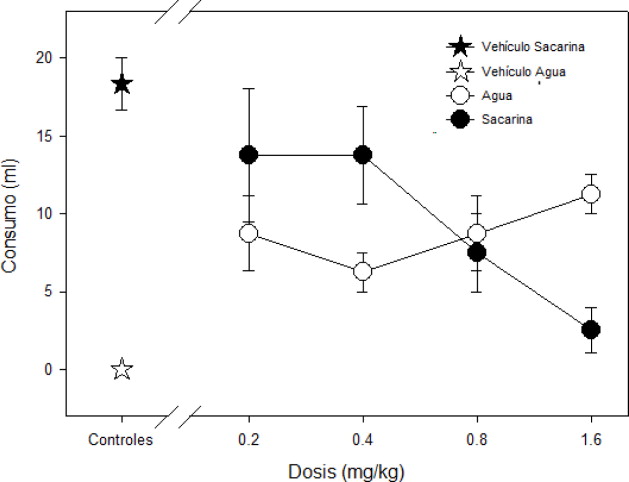
Por otra parte, en el análisis de los datos correspondientes a la prueba de dos botellas, hay una tendencia al incremento en la ingesta del agua con las dosis más altas de nicotina de 0.8 y 1.6 mg/kg, lo que descarta adipsia inducida por la droga. Se puede observar en la Figura 2 que el grupo de vehículo presentó un consumo nulo de agua, prefiriendo la solución de sacarina, mientras que las distintas dosis afectan principalmente el consumo de sacarina, mientras el de agua permanece relativamente estable (verFigura 2 ).
|
|
|
Figura 2. Prueba de dos botellas, se presenta el consumo de los dos diferentes líquidos, solución de sacarina y agua, de acuerdo a las dosis administradas de fármaco y el vehículo. Se observa un decremento significativo de la ingesta de solución de sacarina con la dosis de 1.6 mg/kg. |
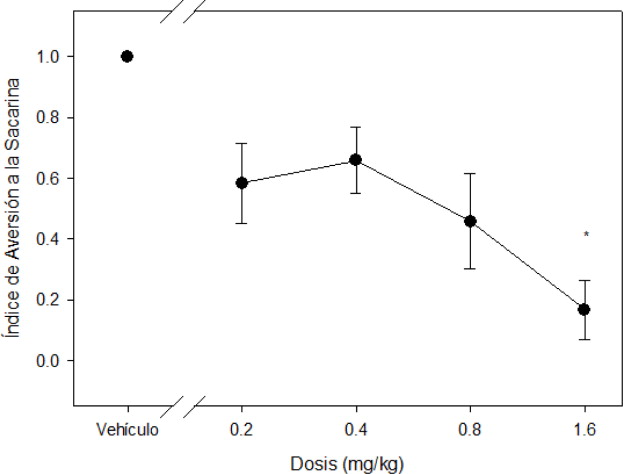
Por último, en la Figura 3 se pueden observar los índices de aversión hacia la solución de sacarina. El ANOVA de una vía revelo diferencias significativas (F [4,14]=5.892; p < 0.005) para las distintas condiciones. La prueba post-hoc de Tukey revelo que la diferencia estadísticamente significativa se observa con la dosis de 1.6 mg/kg ip (índice= 0.16; p< 0.003), sin embargo, se encuentra una tendencia desde la dosis de 0.8 mg/kg ip (p < 0.057) (verFigura 3 ).
|
|
|
Figura 3. Índice de aversión a la sacarina de acuerdo al grupo, se presenta el índice de aversión hacia la solución de sacarina para cada grupo determinado por la fórmula A/A+B, donde A es el consumo de solución de sacarina y B el consumo de agua. Un valor de 1.0 indica preferencia por la solución de sacarina, mientras que un valor de 0.0 indica aversión por la misma. * indica diferencias significativas p<0.05 |
Discusión
Se encontró una tendencia de decremento en el consumo de solución de sacarina dosis-dependiente tras la administración de nicotina en el proceso de CAS. Así mismo, nuestros resultados apuntan que la dosis necesaria de nicotina para producir CAS intenso es de 1.6 mg/kg i.p., sin embargo se pueden empezar a ver tendencias de efectos aversivos a partir de la dosis de 0.8 mg/kg, lo cual concuerda con otras investigaciones (Kumar, Pratt & Stolerman, 1983 ; Shoaib et al., 2002 ). Los resultados obtenidos en el presente estudio nos permiten proponer que los efectos aversivos de la nicotina pueden producir un efecto directo sobre la ejecución de los sujetos dado el malestar periférico dificultando la interpretación de los datos ya que se puede observar una clara tendencia de aversión desde dosis relativamente bajas (0.4 mg/kg) y resultados estadísticamente significativos en dosis más altas (1.6 mg/kg).
La nicotina es el principal componente del tabaco y ha sido propuesta como un fármaco adictivo con propiedades procognitivas (Mansvelder, Mertz & Role, 2009 ). Algunos estudios refieren que pacientes con trastornos neurodegenerativos, como la esquizofrenia, consumen un volumen mayor de cigarrillos ya que reportes de los pacientes aseguran que mejoran algunas de sus funciones cognitivas perdidas (Buccafusco & Terry, 2009 ; Levin & Rezvani, 2007 ; Moss, Sacco, Allen, Weinberger, Vessicchio & George, 2010 ;). Pero al intentar reproducir la administración en organismos no humanos no siempre se toma en cuenta la acidez de la nicotina, la cual se ha descrito que puede causar laceraciones al ser administrada por vía subcutánea, dolor intenso por vía intraperitoneal y los niveles de estrés que produce la propia administración (Murrin, Ferrer, Zeng & Haley, 1987 ). Esto nos permite plantear que efectos producidos por la nicotina pueden ser afectados por la sensación aversiva e incluso el aprendizaje asociativo producto del malestar modificar los resultados obtenidos y la subsecuente interpretación de los datos.
Se ha descrito que la nicotina tiene efectos centrales preferencialmente en los receptores alfa 4 beta 2, produciendo incrementos en la atención, concentración y mejoras en tareas conductuales (Howe, Ji, Parikh, Williams, Mocaër, Trocmé & Sarter, 2010 ), sin embargo, existe evidencia contradictoria acerca de este papel de la nicotina que puede deberse a la especie (Garcha, Kumar, Pratt & Stolerman, 1982 en Kumar, Pratt & Stolerman, 1983 ; Kumar, Pratt & Stolerman, 1983 ; Shoaib et al., 2002 ), vía de administración (Gotti, Guiducci, Tedesco, Corbioli, Zanetti, Moretti, Zanardi, Rimondini, Mugnaini, Clementi, Chiamulera & Zoli, 2010 ) o el tiempo de administración (Rauhut, Hawrylak, & Mardekian, 2008 ).
En estudios previos de laboratorio, se ha encontrado que animales entrenados en tareas de estimación temporal, particularmente en la tarea de pico, la administración de 0.8 mg/kg ip de nicotina afectaba las tasas de respuesta dificultando la interpretación de los resultados dada la deformación de las funciones psicométricas asociadas a este tipo de paradigmas experimentales (Ostos, Arroyo, Paz, Zamora & Sanchez-Castillo, 2012 ).
En conclusión, esta investigación plantea la inserción de tareas adicionales a las evaluadas en estudios que buscan efectos centrales ya que, dadas sus propiedades aversivas en un determinado rango de dosis puede interferir con los resultados obtenidos, por ejemplo disminuyendo la tasa de respuesta, lo que puede traer mayor variabilidad. A esto le podemos aunar que la nicotina puede producir aprendizaje asociativo durante la administración sistémica del fármaco, lo que podría trascender en resultados diferenciales. Finalmente es importante contemplar los efectos procognitivos reportados por diversos grupos de investigación (Barr et al., 2008 ; Mansvelder, Mertz & Role, 2009 ;), ya que actualmente se ha señalado que ésta podría intervenir en la mejora de diversos procesos cognitivos como son el aprendizaje, la memoria y la atención, y que sin embargo no han podido ser replicados en muchos estudios, por ejemplo en el realizado por Zhang et al. (2012) y que podría deberse a un problema relacionado con el efecto aversivo más que con el efecto procognitivo buscado (Lopez & García, 2003 ).
Referencias
- Aggleton, 1986 J. Aggleton, M. Mishkin; The amígdala: Sensory Gateway to the emotions; Emotion: Theory, Research and Experience, 3 (1986), pp. 281–299
- Barr, 2008 R. Barr, M. Culhuane, L. Jubelt, R. Mufti, M. Dyer, A. Weiss, A. Evins; The effects of transdermal nicotine on cognition in nonsmokers with schizophrenia and nonpsychiatric controls; Neuropsychopharmacology, 33 (3) (2008), pp. 480–490
- Bermúdez-Rattoni, 1991 F. Bermúdez-Rattoni, J.L. McGaugh; Insular cortex and amygdala lesions differentially affect acquisition on inhibitory avoidance and conditioned taste aversion; Brain Res, 549 (1991), pp. 165–170
- Buccafusco, 2009 J. Buccafusco, A. Terry; A reversive model of the cognitive impairment associated with schizophrenia in monkey: potential therapeutic effects of two nicotinic acetylcholine receptor agonists; Biochempharmacol, 78 (7) (2009), pp. 852–862
- Bures, 1998 J. Bures, F. Bermudez-Rattoni, T. Yamamoto; The CTA paradigm, Oxford University Press (1998), pp. 1–25
- Chance, 2001 P. Chance; Aprendizaje y conducta, Manual Moderno, México (2001)
- Ciobica, 2012 A. Ciobica, M. Padurariu, L. Hritcu; The effects of short-term nicotine administration on behavioral and oxidative stress deficiencies induced in a rat model of parkinson disease; PsychiatriaDanubina, 24 (2) (2012), pp. 194–205
- Dani, 2012 J. Dani, D. Jensn, J. Broussard, M. De Biasi; Neurophysiology of nicotine addiction; J. Addict. Res. Ther (2012), pp. 1–12
- Domjan, 2010 M. Domjan; Principios de aprendizaje y conducta, Cengage Learning, México (2010)
- Gotti, 2010 C. Gotti, S. Guiducci, V. Tedesco, S. Cornioli, L. Zanetti, M. Moretti, C. Chiamulera, M. Zoli; Nicotinic acetylcholine receptors in the mesolimbic pathway: primary role of ventral tegmental area a6b2 receptors in mediating systemic nicotine effects on dopamine release, locomotion, and reinforcement; The journal neuroscience, 30 (15) (2010), pp. 5311–5325
- Howe, 2010 W. Howe, J. Ji, V. Parik, S. Williams, E. Mocaër, C. Trocmé, M. Sarter; Enhancement of attentional performance by selective stimulation of a4b2 nAChRs: Underlying cholinergic mechanisms; Neuropsychopharmacology, 35 (2010), pp. 1391–1401
- Koh, 2005 M. Koh, I. Bernstein; Mapping conditioned taste aversion associations using c-Fos reveals a dynamic role for insular cortex; Behavioral Neuroscience, 119 (2005), pp. 388–398
- Kumar, 1983 R. Kumar, J. Pratt, I. Stolerman; Characteristics of conditioned taste aversión produced by nicotine in rats; Br. J. Pharmac, 79 (1983), pp. 245–253
- Levin, 2007 E. Levin, A. Rezvani; Nicotinic interactions with antipsychotic drugs, model of schizophrenia and impacts on cognitive function; Biochem pharmacol, 74 (8) (2007), pp. 1182–1191
- López, 2003 H. López, J. García; La participación de los receptores de acetilcolina nicotínicos en trastornos del sistema nervioso central; Salud Mental, 26 (003) (2003), pp. 66–72
- Loy Loy, I., & Hall, G. Taste aversion after ingestion of lithium chloride: An associative analysis. Exp Psychol ., 55(4), 365-380.
- Mansvelder, 2009 H. Mansvelder, M. Mertz, L. Role; Nicotinic modulation of synaptic transmission and plasticity in cortico-limbic circuits; Semin Cell Dev Biol, 20 (4) (2009), pp. 432–440
- Miranda, 2011 F. Miranda, B. Cedillo, J. Jiménez, G. Bedolla, S. Torres; Substitución asimétrica entre metanfetamina y anfetamina: estudio de discriminación de drogas; Revista Mexicana de Análisis de la Conducta [en línea], 37 (1) (2011), pp. 1–12 Recuperado de http://dx.doi.org/10.5514/rmac.v37.i1.24685
- Miranda, 2004 M. Miranda, J. McGaugh; Enhancement of inhibitory avoidance and conditioned taste aversion memory with insular cortex infusions of 8-BrcAMP: Involvement of the basolateral amygdala; Learning and Memory (2004), pp. 312–317
- Misanin, 2002 J. Misanin, M. Collins, S. Rushanan, M. Anderson, M. Goodhart, C. Hinderliter; Aging facilitates long-trace taste-aversion conditioning in rats; Physiol. Behav, 75 (2002), pp. 759–764
- Molero, 2007 A. Molero; Aprendizaje aversivo gustativo: características, paradigma y mecanismos cerebrales; Anales de Psicología [en línea], 23 (2007) Recuperado de http://redalyc.uaemex.mx/redalyc/src/inicio/ArtPdfRed.jsp?iCve=16723108
- Moss, 2010 T. Moss, K. Sacco, T. Allen, A. Weinberger, J. Vessicchio, T. George; Prefrontal cognitive dysfunction is associated with tobacco dependence treatment failure in smokers with schizophrenia; Drug Alcohol Depend, 104 (1/2) (2010), pp. 94–99
- Murrin, 1987 L. Murrin, J. Ferrer, W. Zeng, N. Haley; Nicotine administration to rats: Methodological considerations; Life Sci, 40 (17) (1987), pp. 1699–1708
- Ostos, 2012 A. Ostos, M. Arroyo, D. Paz, O. Zamora, H. Sanchez; Nicotinic modulation in a peak timing task; Society for neuroscience, program no, 809 (19) (2012)
- Rauhut, 2008 A. Rauhut, M. Hawrylak, S. Mardekian; Bupropion differentially alters the aversive, locomotor and rewarding proprieties of nicotine in CD-1 mice; Pharmacol Biochem Behav, 90 (4) (2008), pp. 589–607
- Redolat, 1994 R. Redolat, M. Carrasco, V. Simón; Efectos cognitivos de la nicotina y el tabaco en sujetos humanos; Psicothema, 6 (1) (1994), pp. 5–20
- Rinker, 2008 J. Rinker, G. Busse, P. Roma, S. Chen, C. Barr, A. Riley; The effects of nicotine on ethanol-induced conditioned taste aversions in Long-Evans rats; Psychopharmacology, 197 (3) (2008), pp. 409–419
- Roman, 2010 C. Roman, J.Y. Lin, S. Reilly; Conditioner taste aversion and latent inhibition following extensive taste preexposure in rats with insular cortex lesions; Brain Res (2010), pp. 68–73
- Rushforth, 2011 S. Rushforth, T. Steckler, M. Shoaib; Nicotine improves working memory span capacity in rats following sub-chronic ketamine exposure; Neuropsychopharmacology, 36 (2011), pp. 2774–2781
- Shoaib, 2002 M. Shoaib, J. Gommans, A. Morley, I. Stolerman, R. Grailhe, J. Changeux; The role of nicotinic receptor beta-2 subunits in nicotine discrimination and conditioned taste aversion; Neuropharmacology, 42 (4) (2002), pp. 530–539
- Welzl, 2001 H. Welzl, P. D’Adamo, H.P. Lipp; Conditioned taste aversion as a learning and memory paradigm; Behav. Brain Res, 1 (125) (2001), pp. 205–213
- Wilkins, 2009 E. Wilkins, I. Bernstein; Boosting cholinergic activity in gustatory cortex enhances the salience of a familiar CS in taste aversion learning; Behave neurosci, 123 (4) (2009), pp. 764–771
- Zhang, 2012 X. Zhang, C. Chen, M. Xiu, C. Haile, H. Sun, L. Lu, T. Kosten; Cigarette smoking and cognitive function in chinese male schizophrenia: A case-control study; Plos One, 7 (5) (2012), pp. 1–7