Resumo
O oncocitoma renal representa cerca de 3‐7% dos tumores renais primários. É geralmente diagnosticado acidentalmente e apresenta tipicamente um comportamento benigno. Atualmente, as técnicas de imagem disponíveis não permitem diferenciá‐lo de forma segura de neoplasias renais malignas. De igual modo, o diagnóstico histológico de oncocitoma continua a ser um desafio. Apresentamos um caso clínico de um idoso assintomático, hipertenso, diabético tipo 2 e com insuficiência renal crónica moderada, submetido a uma nefrectomia radical por uma formação nodular sólida exofítica de 4,7 cm no polo renal, detetada de forma acidental. O exame anatomopatológico revelou um oncocitoma renal. Nesta situação, a nefrectomia parcial seria o tratamento cirúrgico mais desejável, evitando‐se o risco a longo prazo de viver com um único rim. A ausência de meios de diagnóstico que permitam diferenciar com segurança entre lesões renais benignas e malignas torna necessário o investimento nesta área, de modo a poder diminuir o número de intervenções cirúrgicas e a morbilidade associada.
Abstract
Renal oncocytoma account for 3 to 7% of primary renal tumors. It is usually diagnosed incidentally and typically has a benign behavior. No currently used imaging techniques can reliably distinguish it from malignant lesions. Similarly, the microscopic diagnosis of oncocytoma remains a challenge. We present a case of an asymptomatic elderly, hypertensive, diabetic and with moderate chronic renal insufficiency, who underwent radical nephrectomy for a solid exophytic lesion of 4.7 cm in the renal pole, detected accidentally. Pathological examination revealed a renal oncocytoma. In this situation, partial nephrectomy would be the preferred surgical treatment, avoiding the long‐term risk of living with a single kidney. The lack of diagnostic tools that reliably differentiate between benign and malignant lesions makes this an important area of study, in order to reduce the number of surgical interventions and the associated morbidity.
Palavras‐chave
Neoplasias renais ; Oncocitoma renal ; Carcinoma de células renais
Keywords
Kidney neoplasms ; Renal oncocytoma ; Renal cell carcinoma
Introdução
As neoplasias de células renais representam um grupo heterogéneo de tumores que incluem o carcinoma de células claras, o tumor papilar, o tumor cromofóbico, o tumor do ducto coletor, o oncocitoma, entre outros1 .
O oncocitoma renal representa cerca de 3‐7% dos tumores renais primários2 ; 3 ; 4 . Este tumor é geralmente diagnosticado acidentalmente, apresentando tipicamente um comportamento benigno2 ; 3 ; 4 . O seu diagnóstico diferencial, com base em aspetos imagiológicos e histológicos, permanece um desafio, pelo que a nefrectomia constitui o seu principal tratamento3 ; 5 .
Os autores apresentam um caso clínico de um doente assintomático, submetido a uma nefrectomia radical por uma formação nodular sólida renal detetada de forma acidental. O exame anatomopatológico revelou um oncocitoma renal. Dada a benignidade da patologia e o impacto do tratamento na situação clínica do doente, fazem ainda uma breve revisão da literatura disponível.
Caso clínico
Doente do sexo masculino, de 75 anos, raça caucasiana, natural do Porto, reformado (serralharia), recorreu ao seu médico assistente para uma consulta de seguimento em 2011. Como antecedentes patológicos apresentava dislipidemia, hipertensão arterial, diabetes mellitus tipo 2 (sem lesão de órgãos alvo) e excesso ponderal. Encontrava‐se medicado com uma associação de candesartan e hidroclorotiazida 16/12,5 mg, gemfibrozil 600 mg, glibenclamida 5 mg (2 id) e aspirina 100 mg. Sem hábitos tabágicos ou alcoólicos conhecidos, nem história de alergias medicamentosas ou de transfusões sanguíneas. Sem antecedentes familiares relevantes.
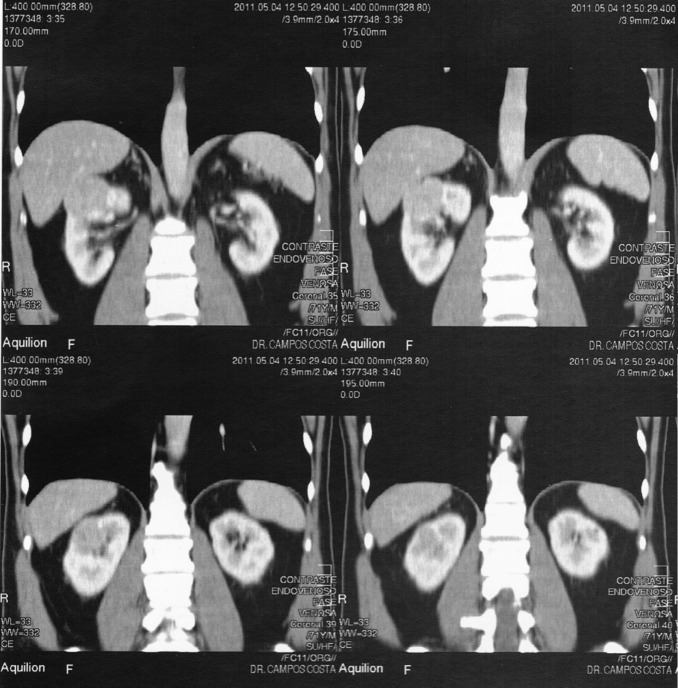
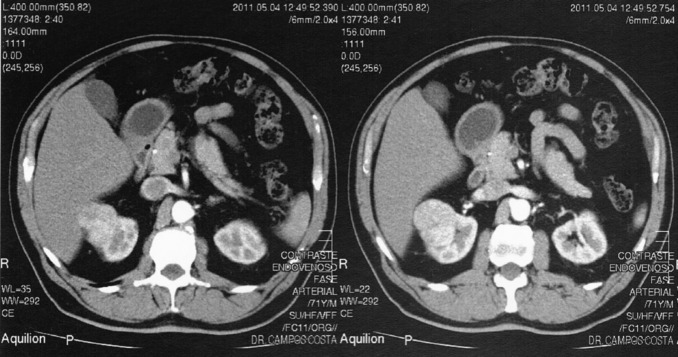
Na consulta de seguimento encontrava‐se assintomático e o exame físico era normal. O estudo analítico trazido pelo doente apresentava as seguintes alterações: glicose 134 mg/dL, HbA1c 6,9%, colesterol total 204 mg/dL, colesterol HDL 34 mg/dL, colesterol LDL 123,6 mg/dL, triglicerídeos 232 mg/dL e creatinina plasmática 1,4 mg/dL (taxa de filtração glomerular estimada [TFGe] – Modification of Diet in Renal Disease [MDRD] – 53,10 mL/min/1,73 m2 ). O exame sumário da urina era normal. Perante o aumento da creatinina plasmática relativamente ao último estudo analítico realizado 6 meses antes (1,25 mg/dL; TFGe – MDRD – 60,69 mL/min/1,73 m2 ), foi solicitada uma ecografia renal que revelou uma formação nodular sólida, de contornos regulares, parcialmente exofítica, na vertente anterior da metade superior do rim direito, com 4,4 × 4,3 cm de diâmetro, sugestiva de neoformação primitiva. O restante exame era normal. Foi realizado estudo complementar com tomografia axial computorizada com contraste ( Figura 1 ; Figura 2 ), confirmando‐se uma lesão nodular sólida no polo renal superior direito, captante de contraste, com 4,7 × 3,7 × 3,2 cm de diâmetro, com contacto posterior com o lobo hepático direito, compatível com neoplasia de células renais. Perante este diagnóstico, o doente foi referenciado para uma consulta urgente de urologia, tendo sido submetido a nefrectomia radical laparoscópica em junho de 2011. O exame macroscópico da peça cirúrgica revelou uma neoplasia de 4,0 × 4,0 × 4,2 cm de diâmetro, bem delimitada, não capsulada e de localização cortical. No exame histológico, observou‐se uma neoplasia epitelial bem delimitada, revestida por fina cápsula fibrosa, e constituída por toalhas de células de citoplasma amplo, granular e eosinófilo, com núcleos redondos e regulares, com ligeira atipia. O índice mitótico era baixo e não se observou necrose, permeação venosa, linfática ou perineural, nem invasão da cápsula renal. Estes resultados foram diagnósticos de oncocitoma renal.
|
|
|
Figura 1. Resultados da tomografia axial computorizada abdominal com contraste (cortes longitudinais) – neoformação no polo renal superior direito. |
|
|
|
Figura 2. Resultados da tomografia axial computorizada abdominal com contraste (cortes transversais) – neoformação no polo renal superior direito. |
O doente mantém vigilância na consulta de urologia, tendo apresentado, desde a cirurgia, várias agudizações da insuficiência renal crónica (tabela 1 ). Atualmente encontra‐se assintomático e sem alterações ao exame físico. A última creatinina plasmática, registada em janeiro de 2015, foi de 1,87 mg/dL (TFGe atual – MDRD – 37,60 mL/min/1,73 m2 ). Os últimos exames de imagem (ecografia renal e tomografia axial computorizada abdominal) não revelaram alterações do rim esquerdo.
| Antes da cirurgia | Depois da cirurgia | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Data | Outubro 2010 | Abril 2011 | Junho 2011 | Setembro 2011 | Março 2012 | Junho 2012 | Janeiro 2013 | Abril 2013 | Novembro 2013 | Janeiro 2014 | Janeiro 2015 |
| Creatinina plasmática (mg/dL) | 1,25 | 1,4 | 2,0 | 2,1 | 2,47 | 2,0 | 2,06 | 2,7 | 1,76 | 1,72 | 1,87 |
| TFGe (MDRD)a (mL/min/1,73m2 ) | 60,69 | 53,10 | 35,18 | 33,26 | 27,50 | 35,08 | 33,81 | 24,74 | 40,54 | 41,54 | 37,60 |
a. TFGe: taxa de filtração glomerular estimada, segundo Modification of Diet in Renal Disease (MDRD).
Discussão
O oncocitoma renal é uma neoplasia que se origina das células intercaladas do ducto coletor, representando 3‐7% de todos os tumores renais primários2 ; 3 ; 4 . Num estudo multicêntrico de uma base de dados europeia3 , verificou‐se que o seu diagnóstico é mais frequente na sexta década de vida, com um ligeiro predomínio no género masculino (1,6:1). Apesar da presença ocasional de características aparentemente invasivas, como o envolvimento vascular ou da cápsula renal, a história natural deste tipo de tumores é tipicamente benigna2 ; 3 ; 4 . O uso generalizado de técnicas de imagem permite a deteção precoce destes tumores, incluindo de incidentalomas encontrados durante a avaliação de outras condições médicas2 . De facto, o diagnóstico é acidental em 56‐91% dos casos2 ; 4 . Contudo, alguns doentes podem apresentar hematúria macroscópica, dor no flanco ou uma massa abdominal palpável2 ; 4 .
O oncocitoma é geralmente uma lesão de limites bem definidos, confinada ao parênquima renal e de tamanho reduzido (média de 4,9 cm de diâmetro, embora possa atingir tamanhos superiores)2 ; 3 ; 4 . Em 95% dos casos é unilateral, podendo ser detetados tumores múltiplos em 6‐13% dos doentes2 ; 4 ; 6 . A coexistência de carcinoma de células renais também é verificada em 10‐32% dos casos2 ; 4 ; 7 . Devido à sobreposição de características, as técnicas de imagem convencionais (tomografia axial computorizada ou ressonância magnética nuclear) não conseguem diferenciar de forma segura o oncocitoma de neoplasias renais malignas2 ; 3 ; 4 ; 6 ; 8 . Ao contrário do que se pensava, a presença de uma cicatriz central estrelada na tomografia computorizada parece relativamente incomum e não específica do oncocitoma renal6 .
Os oncócitos são as células constituintes do oncocitoma2 . Estas são arredondadas ou poligonais e apresentam um citoplasma granular eosinofílico rico em mitocôndrias2 ; 4 ; 9 . A biópsia tumoral percutânea tem sido cada vez mais utilizada para o diagnóstico histológico de massas renais cujos exames de imagem não conseguem prever o seu comportamento biológico, com o objetivo de evitar a cirurgia no caso de lesões benignas; para selecionar os doentes com massas renais pequenas que beneficiam de vigilância clínica exclusiva; para iniciar a terapêutica ablativa; e para determinar o tratamento médico e cirúrgico mais adequado no caso do carcinoma de células renais metastático8 ; 10 ; 11 . Assim, nos doentes com risco cirúrgico, tumores múltiplos ou bilaterais, insuficiência renal ou rim único, a biópsia renal é de grande utilidade, uma vez que o seu resultado pode permitir tratamentos menos invasivos6 ; 11 . No entanto, o diagnóstico histológico do oncocitoma continua a ser um desafio2 ; 10 ; 11 . De facto, a diferenciação entre oncocitoma e as variantes eosinofílicas do carcinoma de células renais cromofóbico, o carcinoma de células renais papilar oncocítico e os tumores híbridos (oncocitomas com áreas de carcinoma cromofóbico), nem sempre é fácil, uma vez que as células oncocíticas também estão presentes neste tipo de carcinomas2 ; 4 ; 5 ; 8 ; 9 ; 10 ; 11 . Além disso, a biópsia não permite o diagnóstico em 2,5‐22% dos casos, sobretudo se a massa renal for pequena (≤ 4 cm)8 ; 12 . As complicações associadas à biópsia são raras, sendo a hemorragia autolimitada a complicação mais frequente10 . Também a frequência de efeitos adversos graves, tais como hematúria macroscópica persistente, hemorragia retroperitoneal com necessidade de transfusões ou de nefrectomia, ou fistulas arteriovenosas, é muito baixa (< 1%)10 . O risco de sementeira ao longo do trajeto da agulha é igualmente reduzido10 . No entanto, na suspeita de carcinoma urotelial, a biópsia não poderá ser realizada, devido à elevada probabilidade de sementeira10 .
A vigilância ativa está preconizada nos indivíduos com diagnóstico definitivo de oncocitoma, confirmado por biópsia, sendo ideal para doentes com múltiplas comorbilidades2 ; 8 ; 13 . No caso de o diagnóstico não estar confirmado histologicamente, o principal tratamento deste tipo de lesão renal é cirúrgico3 ; 8 . Vários são os argumentos a favor da nefrectomia parcial, incluindo o risco de ocorrência de um tumor contralateral em 2‐5% dos casos ao fim de 8 anos e o risco a longo prazo de viver com um único rim (maior incidência de insuficiência renal crónica e de proteinúria), tornando a nefrectomia radical uma opção mais arriscada3 ; 8 ; 14 . Assim, a nefrectomia parcial está indicada nos tumores com diâmetro inferior ou igual a 4 cm e nos tumores localizados nos polos renais, incluindo aqueles com mais de 4 cm2 ; 14 .
A crioterapia e a ablação por radiofrequência poderão ser uma alternativa em idosos com incidentalomas pequenos, em tumores bilaterais, em doentes com rim único e com compromisso da função renal ou em indivíduos com predisposição genética para desenvolver tumores múltiplos3 ; 8 .
Num doente idoso com uma lesão exofítica de 4,7 cm no polo renal e com antecedentes de hipertensão arterial, diabetes mellitus tipo 2 e insuficiência renal crónica moderada, o tratamento cirúrgico mais desejável seria a nefrectomia parcial. No entanto, foi decidido pela equipa médica hospitalar não ser possível a sua realização, pelo que se optou pela nefrectomia radical, com consequente agravamento da insuficiência renal.
Perante uma insuficiência renal crónica moderada num indivíduo idoso com rim único, deve ser estabelecido um plano de ação individualizado, que inclui não só o tratamento das comorbilidades e a avaliação e o tratamento das complicações da doença renal crónica, como também a implementação de estratégias de prevenção da sua progressão15 . Incluídas nestas medidas encontram‐se a restrição proteica e salina, a redução da proteinúria, o controlo da hipertensão arterial, da diabetes mellitus e da anemia, e a cessação tabágica 15 ; 16 . A medicação também deverá ser revista em todas as consultas, ajustando as doses dos fármacos à função renal apresentada 17 ; 18 .
Em conclusão, a capacidade de discriminar definitiva e seguramente entre lesões de oncocitoma e neoplasias renais malignas, usando técnicas imagiológicas ou histológicas, poderia poupar os pacientes da morbilidade da cirurgia2 ; 14 . A análise molecular e genética das amostras de biópsia poderá fornecer informação diagnóstica adicional, contribuindo para a decisão do tratamento (conservador versus cirurgia), pelo que se mostra necessário investir nesta área5 ; 11 .
Responsabilidades éticas
Proteção de pessoas e animais
Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados
Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escrito
Os autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Referências
- 1 J.R. Srigley, B. Delahunt, J.N. Eble, L. Egevad, J.I. Epstein, D. Grignon, et al.; The International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia; Am J Surg Pathol., 37 (2013), pp. 1469–1489
- 2 S.M. Schatz, M.M. Lieber; Update on oncocytoma; Curr Urol Rep, 4 (2003), pp. 30–35
- 3 L. Romis, L. Cindolo, J.J. Patard, G. Messina, V. Altieri, L. Salomon, et al.; Frequency, clinical presentation and evolution of renal oncocytomas: Multicentric experience from a European database; Eur Urol., 45 (2004), pp. 53–57
- 4 D.H. Chao, A. Zisman, A.J. Pantuck, S.J. Freedland, J.W. Said, A.S. Belldegrun; Changing concepts in the management of renal oncocytoma; Urology., 59 (2002), pp. 635–642
- 5 K.L. Ng, R. Rajandram, C. Morais, N.Y. Yap, H. Samaratunga, G.C. Gobe, et al.; Differentiation of oncocytoma from chromophobe renal cell carcinoma (RCC): Can novel molecular biomarkers help solve an old problem?; J Clin Pathol., 67 (2014), pp. 97–104
- 6 S. Choudhary, A. Rajesh, N.J. Mayer, K.A. Mulcahy, A. Haroon; Renal oncocytoma: CT features cannot reliably distinguish oncocytoma from other renal neoplasms; Clin Radiol., 64 (2009), pp. 517–522
- 7 C.B. Dechet, D.G. Bostwick, M.L. Blute, S.C. Bryant, H. Zincke; Renal oncocytoma: Multifocality, bilateralism, metachronous tumor development and coexistent renal cell carcinoma; J Urol., 162 (1999), pp. 40–42
- 8 B. Ljungberg, K. Bensalah, S. Canfield, S. Dabestani, F. Hofmann, M. Hora, et al.; EAU Guidelines on Renal Cell Carcinoma: 2014 Update; Eur Urol., 67 (5) (2015), pp. 913–924
- 9 N. Kuroda, M. Toi, M. Hiroi, T. Shuin, H. Enzan; Review of renal oncocytoma with focus on clinical and pathobiological aspects; Histol Histopathol., 18 (2003), pp. 935–942
- 10 M. Remzi, M. Marberger; Renal tumor biopsies for evaluation of small renal tumors: Why, in whom, and how?; Eur Urol., 55 (2) (2009), pp. 359–367
- 11 A. Volpe, A. Finelli, I.S. Gill, M.A. Jewett, G. Martignoni, T.J. Polascik, et al.; Rationale for percutaneous biopsy and histologic characterisation of renal tumours; Eur Urol., 62 (3) (2012), pp. 491–504
- 12 M.J. Leveridge, A. Finelli, J.R. Kachura, A. Evans, H. Chung, D.A. Shiff, et al.; Outcomes of small renal mass needle core biopsy, nondiagnostic percutaneous biopsy, and the role of repeat biopsy; Eur Urol., 60 (3) (2011), pp. 578–584
- 13 S. Kawaguchi, K.A. Fernandes, A. Finelli, M. Robinette, N. Fleshner, M.A. Jewett; Most renal oncocytomas appear to grow: Observations of tumor kinetics with active surveillance; J Urol., 186 (4) (2011), pp. 1218–1222
- 14 P. Russo; Evolving understanding and surgical management of renal cortical tumors; Mayo Clin Proc., 75 (2000), pp. 1233–1235
- 15 C.A. Johnson, A.S. Levey, J. Coresh, A. Levin, J. Lau, G. Eknoyan; Clinical practice guidelines for chronic kidney disease in adults: Part I . Definition, disease stages, evaluation, treatment, and risk factors ; Am Fam Physician., 70 (5) (2004), pp. 869–876
- 16 R.G. Fassett; Current and emerging treatment options for the elderly patient with chronic kidney disease; Clin Interv Aging., 9 (2014), pp. 191–199
- 17 R.K. Verbeeck, F.T. Musuamba; Pharmacokinetics and dosage adjustment in patients with renal dysfunction; Eur J Clin Pharmacol., 65 (8) (2009), pp. 757–773
- 18 M.Y. Munar, H. Singh; Drug dosing adjustments in patients with chronic kidney disease; Am Fam Physician., 75 (10) (2007), pp. 1487–1496
Document information
Published on 11/04/17
Licence: Other
Share this document
Keywords
claim authorship
Are you one of the authors of this document?