(Created page with "==Resumo== ====Introdução==== Até ao fim dos anos 80 defendia‐se que qualquer nódulo testicular suspeito devia ser excisado com orquidectomia radical. No entanto, com...") |
m (Scipediacontent moved page Draft Content 925690168 to Almeida-Dores et al 2015a) |
||
| (One intermediate revision by the same user not shown) | |||
| Line 3: | Line 3: | ||
====Introdução==== | ====Introdução==== | ||
| − | + | Ao longo das últimas 3 décadas o papel da nefrectomia nos doentes com carcinoma de células renais (CCR) metastizado tem sofrido várias alterações, resultado da implementação das terapêuticas sistémicas como as citocinas (IL‐2, INF‐α) e mais recentemente dos inibidores da angiogénese e da via mTor. Utilizando um caso clínico como ponto de partida, realizámos uma revisão da literatura com o objetivo de questionar se existe ainda lugar para nefrectomia citorredutora numa «era» claramente assumida pelas terapêuticas sistémicas. | |
====Caso clínico==== | ====Caso clínico==== | ||
| − | Apresentamos o caso de um doente de | + | Apresentamos o caso de um doente de 53 anos, com o diagnóstico de CCR metastizado e que foi submetido a nefrectomia citoredutora por via laparoscópica após realização de terapêutica neoadjuvante com sunitinib. |
| + | |||
| + | ====Discussão==== | ||
| + | |||
| + | Apesar da nefrectomia citoredutora ter sido associada a um aumento da sobrevida global dos doentes com CCR metastizado quando complementada pela imunoterapia (INF‐α, Il‐2), a morbilidade e mortalidade inerente à cirurgia e os resultados demonstrados pelos esquemas de monoterapia com os inibidores da angiogénese, entre eles o sunitinib, lançaram o debate sobre o verdadeiro benefício da nefrectomia. Neste sentido têm sido realizados estudos que procuram demonstrar se existe benefício em utilizar o sunitinib antes e/ou após a cirurgia ou apenas em esquema de monoterapia. Foi demonstrado que o sunitinib neoadjuvante permite não só diminuir a dimensão do tumor renal primário (CCR – células claras) com benefício na sobrevida global dos doentes, como permite detetar precocemente os doentes refratários à terapêutica sistémica e que provavelmente não beneficiarão da cirurgia. | ||
| + | |||
| + | ====Conclusão==== | ||
| + | |||
| + | Os estudos preliminares indicam que o tratamento dos doentes com CCR metastizado dependerá provavelmente de uma abordagem que inclua quer a nefrectomia citorredutora quer as terapêuticas sistémicas. | ||
==Abstract== | ==Abstract== | ||
| Line 13: | Line 21: | ||
====Introduction==== | ====Introduction==== | ||
| − | + | Over the past three decades, nephrectomy for the treatment of patients with metastatic renal cell carcinoma (mRCC) has undergone several modifications, resulting from the implementation of systemic therapies, such as those using cytokines (IL‐2 and IFN‐α), and more recently molecular targeted therapies, such as inhibitors of angiogenesis and mTor. Using a case report as a starting point, we conducted a literature review to determine whether there is still a place for cytorreductive nephrectomy in an “era” that sees the increasing use of systemic therapies. | |
| + | |||
| + | ====Clinical case==== | ||
| + | |||
| + | We present a 53‐year‐old patient who was diagnosed with metastatic RCC and underwent laparoscopic cytorreductive nephrectomy after completion of neo‐adjuvant therapy with Sunitinib. | ||
| + | |||
| + | ====Discussion==== | ||
| + | |||
| + | Although cytorreductive nephrectomy is associated with an increase in the overall survival of patients with metastatic RCC when it is accompanied by immunotherapy (INF‐α and IL‐2), the morbidity and mortality inherent to surgery and the positive results obtained by monotherapy regimens, including inhibitors of angiogenesis, such as Sunitinib, has launched a debate on the true benefit of nephrectomy. With this in mind, we analised studies to evaluate whether there is a benefit in administering Sunitinib before and/or after surgery, or just as part of a monotherapy regimen. We found that neo‐adjuvant Sunitinib therapy not only reduced the size of the primary renal tumor, with an increase in the overall survival of the patients, but also allowed the early detection of patients who were refractory to systemic therapy and not likely to benefit from surgery. | ||
| − | ==== | + | ====Conclusion==== |
| − | + | Preliminary studies indicate that treatment of patients with metastatic RCC will probably depend on an approach that includes both cytorreductive nephrectomy and systemic therapies | |
==Palavras‐chave== | ==Palavras‐chave== | ||
| − | + | Nefrectomia citorredutora ; Carcinoma das células renais metastizado ; Sunitinib ; Sobrevida global ; Prognóstico | |
==Keywords== | ==Keywords== | ||
| − | + | Cytorreductive nephrectomy ; Metastatic renal cell carcinoma ; Sunitinib ; Overal survival ; Prognosis | |
==Introdução== | ==Introdução== | ||
| − | + | Entre todas as neoplasias malignas urológicas o carcinoma de células renais (CCR) é considerado o mais letal[[#bib0095|<sup>1</sup>]] . | |
| − | + | Histologicamente, 85% dos CCR são de células claras e na altura do diagnóstico aproximadamente 20‐30% dos doentes já apresenta doença síncrona metastática, com mau prognóstico[[#bib0100|<sup>2</sup>]] . Adicionalmente, dos doentes nefrectomizados, cerca de 20% vão recidivar e desenvolver metástases durante o período de follow‐up[[#bib0105|<sup>3</sup>]] . | |
| − | A | + | A abordagem terapêutica do CCR metastizado tem sofrido muitas transformações ao longo das últimas décadas, resultado do aparecimento de novas terapêuticas sistémicas. Inicialmente, a nefrectomia citorredutora tinha apenas uma indicação paliativa, não se definindo nenhum benefício na sobrevida global. No fim da década de 90, na era das citocinas (INF‐α, IL‐2), demonstrou‐se o benefício da cirurgia em termos de sobrevida global, quando realizada em doentes de baixo risco e antes da terapêutica sistémica. Nos últimos anos, novos fármacos, nomeadamente os inibidores da angiogénese (sunitinib, sorafenib, etc.) e inibidores da via ''mTOR'' (temsirolimus, everolimus) impuseram‐se pelo seu impacto positivo na sobrevivência dos doentes, substituindo quase por completo as citocinas e questionando novamente o interesse da nefrectomia citorredutora. |
==Caso clínico== | ==Caso clínico== | ||
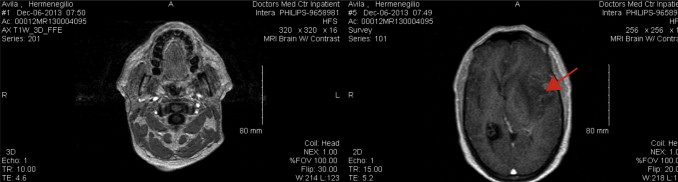
| − | Apresentamos o caso | + | Apresentamos o caso de um doente do sexo masculino, 53 anos, residente na Flórida, Estados Unidos da América (EUA), aparentemente saudável e sem antecedentes pessoais relevantes. Observado no serviço de urgência do Hospital ''Doctor Medical Center of Modesto'' no contexto de um quadro clínico de afasia e desorientação. Por suspeita de intoxicação etanólica fez o despiste toxicológico que se revelou negativo e realizou ressonância magnética cerebral (RMN) que revelou uma massa do córtex frontal à esquerda com 5 cm de maior diâmetro ([[#fig0005|fig. 1]] ). |
<span id='fig0005'></span> | <span id='fig0005'></span> | ||
| Line 46: | Line 62: | ||
| − | [[Image:draft_Content_925690168-1-s2.0- | + | [[Image:draft_Content_925690168-1-s2.0-S2341402215000294-gr1.jpg|center|px|Identifica‐se lesão com 5cm de maior eixo no córtex frontal à esquerda em ...]] |
| Line 54: | Line 70: | ||
Figura 1. | Figura 1. | ||
| − | + | Identifica‐se lesão com 5 cm de maior eixo no córtex frontal à esquerda em cortecoronal da ressonância magnética. | |
</span> | </span> | ||
|} | |} | ||
| − | + | Foi submetido a uma craniotomia temporoparietal esquerda com biópsia e excisão da massa que revelou um CCR, de células claras, Furhman 2, com o estadiamento pTX NX M1. Neste contexto fez uma Tomografia Axial Computorizada (TAC) toraco‐abdomino‐pélvica (T‐A‐P) que demonstrou um volumoso tumor renal à direita, com cerca de 11 cm de maior diâmetro, múltiplas adenopatias lomboaórticas, no entanto, sem aparentes depósitos secundários pulmonares, hepáticos ou ósseos (tivemos acesso ao relatório do exame, sem imagens). Foi referenciado ao departamento de oncologia onde iniciou terapêutica sistémica com sunitinib, tendo realizado apenas um ciclo (esquema 4/2, 50 mg/dia). | |
| + | |||
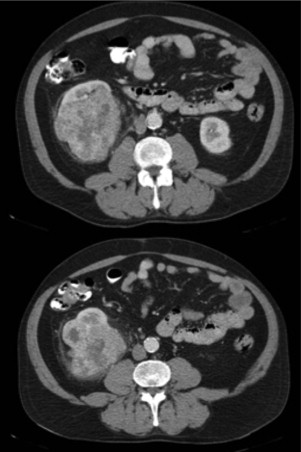
| + | Por motivos económicos, o doente abandona o tratamento e o hospital em agosto de 2013. Passa a ser acompanhado em Portugal, no Hospital Prof. Doutor Fernando Fonseca, e finalmente em fevereiro de 2014 (6 meses depois) é observado em consulta de oncologia e reestadiado. A TAC T‐A‐P revelou uma massa renal com 10,5 cm de maior eixo à direita, com adenopatias lomboaórticas hilares e interaortocava, ainda que sem evidência de metastização pulmonar, hepática ou óssea ([[#fig0010|fig. 2]] ). | ||
<span id='fig0010'></span> | <span id='fig0010'></span> | ||
| Line 68: | Line 86: | ||
| − | [[Image:draft_Content_925690168-1-s2.0- | + | [[Image:draft_Content_925690168-1-s2.0-S2341402215000294-gr2.jpg|center|301px|TAC toraco‐abdomino‐pélvica de reestadiamento, realizada em Portugal, 6 meses ...]] |
| Line 76: | Line 94: | ||
Figura 2. | Figura 2. | ||
| − | + | TAC toraco‐abdomino‐pélvica de reestadiamento, realizada em Portugal, 6 meses após a realização de um ciclo de, ''sunitinib'' nos EUA. | |
</span> | </span> | ||
|} | |} | ||
| + | |||
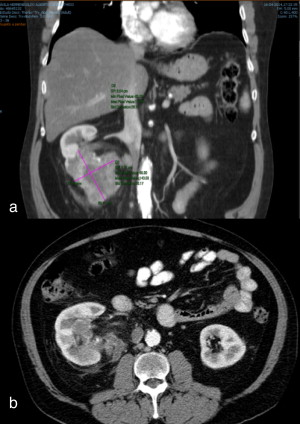
| + | O doente encontrava‐se assintomático, sem hematúria e com bom estado geral. Após discussão multidisciplinar optou‐se por realizar mais 2 ciclos de sunitinib (50 mg/dia 4 semanas com interrupção de 2 semanas) de forma a avaliar a resposta em termos de redução da dimensão do tumor renal primário e do bulking ganglionar justa‐hilar e justa‐Psoas. A nova TAC revelou diminuição da dimensão da massa renal para 9 cm x 7 cm e diminuição do conglomerado adenopático hilar ([[#fig0015|fig. 3]] ). | ||
<span id='fig0015'></span> | <span id='fig0015'></span> | ||
| Line 88: | Line 108: | ||
| − | [[Image:draft_Content_925690168-1-s2.0- | + | [[Image:draft_Content_925690168-1-s2.0-S2341402215000294-gr3.jpg|center|300px|a) Tumor do polo inferior do rim direito, com 9cmx7 após realização de sunitinib ...]] |
| Line 96: | Line 116: | ||
Figura 3. | Figura 3. | ||
| − | + | a) Tumor do polo inferior do rim direito, com 9 cm x 7 após realização de ''sunitinib'' (2 ciclos), b) conglomerado adenopático hilar e justa, Psoas. | |
| − | + | </span> | |
| + | |} | ||
| + | |||
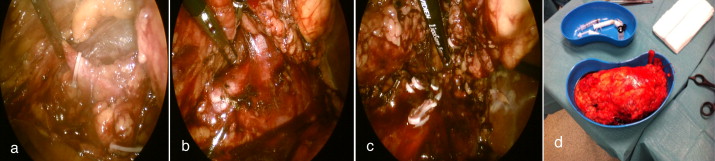
| + | Pela aparente ressecabilidade cirúrgica, idade do doente, score do ''Memorial Sloan‐Kettering Cancer Center'' (MSKCC) e boa resposta à terapêutica com sunitinib, optou‐se pela realização da nefrectomia radical citorredutora por via laparoscópica que decorreu sem intercorrências. Na TAC de reestadiamento identificou‐se metastização pulmonar de novo e progressão de doença ganglionar e optou‐se pela reintrodução de sunitinib, 3 ciclos, 37,5 mg/dia (dosagem reduzida no contexto de hipotiroidismo). Atualmente aguarda TAC de reestadiamento, no entanto, sabemos que pela agressividade do tumor (Furhman 4) o prognóstico não é favorável [[#fig0020|fig. 4]] . | ||
| + | |||
| + | <span id='fig0020'></span> | ||
| + | |||
| + | {| style="text-align: center; border: 1px solid #BBB; margin: 1em auto; max-width: 100%;" | ||
| + | |- | ||
| + | | | ||
| + | |||
| + | |||
| + | [[Image:draft_Content_925690168-1-s2.0-S2341402215000294-gr4.jpg|center|px|Nefrectomia citorredutora laparoscópica direita. a) Laqueação do ureter, b) ...]] | ||
| + | |||
| + | |||
| + | |- | ||
| + | | <span style="text-align: center; font-size: 75%;"> | ||
| + | |||
| + | Figura 4. | ||
| + | |||
| + | Nefrectomia citorredutora laparoscópica direita. a) Laqueação do ureter, b) isolamento da veia renal direita, c) laqueação da veia gonadal veia renal e artéria renal, d) peça de nefrectomia radical. | ||
| + | |||
| + | Anatomia patológica: CCR, células claras, Furhman 4, pT3aN2, margem hilar ocupada e restantes margens livres. | ||
</span> | </span> | ||
| Line 105: | Line 147: | ||
==Discussão== | ==Discussão== | ||
| − | + | Historicamente, a nefrectomia citorredutora no CCR metastizado baseou‐se no fenómeno imunológico raro, mas descrito, de regressão espontânea das metástases após a nefrectomia e na incapacidade das citocinas sistémicas induzirem uma resposta no tumor renal primário[[#bib0110|<sup>4</sup>]] . | |
| + | |||
| + | Inicialmente foi utilizada como uma ferramenta meramente paliativa, no entanto, com o aparecimento das citocinas sistémicas, nomeadamente o INF‐α sustentado por 2 estudos prospetivos, o Southwest Oncology Group (SWOG) 8.949 e o European Organization for Research and Treatment of Cancer (EORTC) 30.947, conseguiu‐se demonstrar que a nefrectomia associada ao INF‐α adjuvante aumentava em cerca de 6 meses a sobrevida média global do doente, quando comparado com o INF‐ α isoladamente<sup>[[#bib0115|5]] ; [[#bib0120|6]]</sup> . Mais tarde demonstrou‐se que a IL‐2 estava associada a um ganho de sobrevida ainda maior (cerca de 4 meses em relação ao INF‐α). De referir que nestes estudos apenas se contemplavam doentes de baixo risco (bom estado geral, metastização única pulmonar e com capacidade para fazer terapêutica adjuvante) e que não preenchiam nenhum dos critérios de estratificação de alto risco definidos pela MSKCC. | ||
| + | |||
| + | Com aparecimento dos novos fármacos, nomeadamente os inibidores da angiogénese e os inibidores da via mTOR, a abordagem ao CCR metastizado modificou‐se e o interesse da nefrectomia foi novamente questionado. | ||
| + | |||
| + | O sunitinib faz parte do grupo dos inibidores da tirosina quinases nomeadamente o VEGF, PDGFR, VEGFR, c‐KIT e FLT‐3, apresentando uma atividade antitumoral e antiangiogénica. Conseguiu colocar para segundo plano a utilização do INF‐α na monoterapia do CCR metastizado através de um estudo de fase III, onde se demonstrou que a sua utilização em doentes de risco baixo/intermédio, para além de segura, estava associada a um aumento de sobrevida média em cerca de 6 meses (11 meses vs. 5 meses; p < 0,000001)[[#bib0125|<sup>7</sup>]] . | ||
| + | |||
| + | Atualmente, a terapêutica sistémica dirigida ocupa a linha da frente na abordagem terapêutica destes doentes e nesse sentido questionamos: qual o papel da nefrectomia citorredutora no CCR metastizado? Deve ser feita? Se sim, em que momento? | ||
| + | |||
| + | A nefrectomia citorredutora tem sido muito contestada argumentando‐se o atraso que condiciona na implementação da terapêutica sistémica, permitindo a progressão da doença, mas também a morbilidade e mortalidade associada. | ||
| + | |||
| + | No entanto, neste momento, o enquadramento da nefrectomia citorredutora nas atuais guidelines está dependente de uma série de estudos prospetivos que se encontram em curso. | ||
| − | + | Um deles é o CARMENA[[#bib0130|<sup>8</sup>]] , que inclui mais de 1.000 doentes com CCR tipo células claras, metastizado, com boa performance status e onde se compara a sobrevida global na terapêutica isolada com sunitinib vs. nefrectomia citorredutora complementada com sunitinib adjuvante, no entanto, os resultados só serão divulgados para meados de 2016/2017. | |
| − | No caso apresentado, | + | No contexto do caso clínico apresentado, também já se iniciaram estudos que procuram demonstrar o interesse da utilização dos inibidores da angiogénese, nomeadamente o sunitinib, como terapêutica neoadjuvante. |
| − | + | Várias vantagens foram associadas a este esquema terapêutico, nomeadamente a rapidez da implementação da terapêutica sistémica, permitindo poupar o tempo perdido com o planeamento, realização e recuperação da cirurgia, evitando assim a progressão da doença. | |
| − | + | Outra vantagem está na possibilidade de diminuir o tumor renal primário e eventualmente converter tumores irressecáveis em tumores ressecáveis. | |
| − | + | De acordo com a literatura, verifica‐se que a utilização de sunitinib (pelo menos 2 ciclos, 50 mg) previamente à nefrectomia citorredutora, em doentes com CCR metastizados, de risco baixo/intermédio (critérios do MSKCC), parece ser uma abordagem segura, associada a uma diminuição em média do tumor renal primário de aproximadamente 10%, contribuindo para uma maior sobrevida global do doente. Quanto maior for a resposta no tumor renal primário e nos depósitos metastáticos melhor o prognóstico em termos de sobrevida global do doente<sup>[[#bib0135|9]] ; [[#bib0140|10]] ; [[#bib0145|11]] ; [[#bib0150|12]]</sup> . Para além do sunitinib, também estão descritos estudos com a utilização de sorafenib (400 mg 2 x/dia durante 4 semanas) e bevacizumab (10 mg/kg, uma toma de 2/2 semanas durante 8 semanas) com intuito neoadjuvante no CCR metastizado, mas com resultados inferiores em termos de sobrevida global e redução da dimensão média do tumor renal primário<sup>[[#bib0155|13]] ; [[#bib0160|14]]</sup> . | |
| − | + | Segundo ''Powles'' et al. nos doentes de risco baixo/intermédio submetidos a sunitinib neoadjuvante e nefrectomia citorredutora a sobrevida global foi de 26 meses comparando com apenas 9 meses nos doentes de alto risco [[#bib0150|<sup>12</sup>]] . | |
| − | + | É importante referir que se constatou que a interrupção da terapêutica com sunitinib condicionada pela cirurgia (entre 3‐4 semanas) e que procura evitar complicações como o atraso na cicatrização esteve associada a progressão da doença em cerca de 33% dos doentes, no entanto, com estabilização após a sua reintrodução, em cerca de 70% dos casos[[#bib0150|<sup>12</sup>]] . Curiosamente, este facto é reconhecido e deixa a dúvida se a cirurgia não será um obstáculo terapêutico. | |
| − | + | A realização da terapêutica neoadjuvante pode estar associada a outra vantagem potencial, nomeadamente, identificar os doentes refratários (segundo alguns estudos até cerca de 19%) e nesse sentido evitar a realização da nefrectomia citorredutora, que parece não trazer benefício nestes doentes de alto risco[[#bib0150|<sup>12</sup>]] . No entanto, esta situação é controversa, na medida que existem argumentos a favor de que a própria nefrectomia aumenta a resposta à terapêutica sistémica, diminuindo assim o número de doentes refratários[[#bib0165|<sup>15</sup>]] . | |
| − | + | Por fim, está a decorrer um estudo prospetivo de fase III''(SURTIME'' ) [[#bib0170|<sup>16</sup>]] que pretende comparar, em termos de sobrevivência livre de doença, a realização de nefrectomia logo após o diagnóstico vs. a nefrectomia só após a realização de 3 ciclos de sunitinib. Este estudo virá complementar o estudo CARMENA e permitir‐nos‐á tirar mais conclusões. | |
| − | + | Em termos cirúrgicos, a nefrectomia citorredutora via aberta ou laparoscópica após terapêutica sistémica dirigida é tecnicamente mais difícil, condicionada por aumento da fibrose dos tecidos, neovascularização e perda dos planos anatómicos, resultando em maiores perdas sanguíneas, maior duração da cirurgia e maior número de dias de internamento. A toxicidade do sunitinib foi consistente com o seu perfil de segurança. Para qualquer grau de toxicidade os efeitos adversos mais frequentes são o rash cutâneo, diarreia, fadiga e mucosite. Em termos perioperatórios, a mielosupressão, nomeadamente anemia e trombocitopenia, podem implicar transfusão de elementos sanguíneos pré‐operatórios; a hipertensão, prolongamento do intervalo QT e disfunção ventricular esquerda podem ter implicações anestésicas e como tal recomenda‐se a realização de um ecocardiograma pré‐operatório[[#bib0175|<sup>17</sup>]] . Ainda assim, é uma cirurgia exequível e com complicações semelhantes quando comparada com uma nefrectomia radical num doente não metastizado e não submetido a terapêutica neoadjuvante[[#bib0180|<sup>18</sup>]] . | |
==Conclusão== | ==Conclusão== | ||
| − | + | O debate entre a importância e o papel da nefrectomia citorredutora vai manter‐se enquanto não surgirem novos resultados dos vários estudos em curso. Até lá, a nefrectomia citorredutora deve ser recomendada, se exequível, nos doentes com CCR metastizado, incluídos no grupo de risco baixo e intermédio segundo o MSKCC. Os resultados apresentados na literatura da utilização dos inibidores da angiogénese, nomeadamente o sunitinib, com intuito neoadjuvante, nos doentes com CCR metastizado, ainda permanecem insuficientes para que se possa adotar de forma estandardizada. | |
==Responsabilidades éticas== | ==Responsabilidades éticas== | ||
| Line 139: | Line 193: | ||
===Confidencialidade dos dados=== | ===Confidencialidade dos dados=== | ||
| − | Os autores declaram | + | Os autores declaram que não aparecem dados de pacientes neste artigo. |
===Direito à privacidade e consentimento escrito=== | ===Direito à privacidade e consentimento escrito=== | ||
| − | Os autores declaram | + | Os autores declaram que não aparecem dados de pacientes neste artigo. |
==Conflito de interesses== | ==Conflito de interesses== | ||
| Line 152: | Line 206: | ||
<ol style='list-style-type: none;margin-left: 0px;'><li><span id='bib0095'></span> | <ol style='list-style-type: none;margin-left: 0px;'><li><span id='bib0095'></span> | ||
| − | [[#bib0095|1]] | + | [[#bib0095|1]] S. Lam, O. Shvarts, J.T. Leppert, A.S. Figlin; Belldegrun Renal cell carcinoma 2005: New frontiers in staging, prognostication and targeted molecular therapy; J Urol, 173 (6) (2005), pp. 1853–1862</li> |
<li><span id='bib0100'></span> | <li><span id='bib0100'></span> | ||
| − | [[#bib0100|2]] | + | [[#bib0100|2]] K. Gupta, J.D. Miller, J.Z. Li, M.W.C. Russell; Charbonneau epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): A literature review; Cancer Treat Rev, 34 (2008), pp. 193–205</li> |
<li><span id='bib0105'></span> | <li><span id='bib0105'></span> | ||
| − | [[#bib0105|3]] | + | [[#bib0105|3]] U. Athar, T.C. Gentile; Treatment options for metastatic renal cell carcinoma: A review; Can J Urol, 15 (2008), pp. 3954–3966</li> |
<li><span id='bib0110'></span> | <li><span id='bib0110'></span> | ||
| − | [[#bib0110|4]] | + | [[#bib0110|4]] B.I. Rini, S.C. Campbell, B. Escudier; Renal cell carcinoma; Lancet., 373 (9669) (2009), pp. 1119–1132</li> |
<li><span id='bib0115'></span> | <li><span id='bib0115'></span> | ||
| − | [[#bib0115|5]] R. | + | [[#bib0115|5]] R.C. Flanigan, S.E. Salmon, B.A. Blumenstein, S.I. Bearman, V. Roy, P.C. McGrath, ''et al.''; Nephrectomy followed by interferon alfa‐2b compared with interferon alfa‐2b alone for metastatic renal cancer; N Engl J Med, 345 (2001), pp. 1655–1659</li> |
<li><span id='bib0120'></span> | <li><span id='bib0120'></span> | ||
| − | [[#bib0120|6]] | + | [[#bib0120|6]] M.M. Walther, R.B. Alexander, G.H. Weiss, D. Venzon, A. Berman, H.I. Pass, ''et al.''; Cytoreductive surgery prior to interleukin‐2‐based therapy in patients with metastatic renal cell carcinoma; Urology, 42 (1993), pp. 250–258</li> |
<li><span id='bib0125'></span> | <li><span id='bib0125'></span> | ||
| − | [[#bib0125|7]] | + | [[#bib0125|7]] Overall survival with sunitinib versus interferon (IFN)‐alfa as first‐line treatment of metastatic renal cell carcinoma (mRCC); J Clin Oncol (Meeting Abstracts), 26 (15) (2008), p. 5024</li> |
<li><span id='bib0130'></span> | <li><span id='bib0130'></span> | ||
| − | [[#bib0130|8]] | + | [[#bib0130|8]] Clinical trial to assess the importance of nephrectomy (CARMENA), US National Institutes of Health, Disponível em: http://clinicaltrials.gov/ct2/show/NCT00930033</li> |
<li><span id='bib0135'></span> | <li><span id='bib0135'></span> | ||
| − | [[#bib0135|9]] | + | [[#bib0135|9]] B.I. Rini, J. Garcia, P. Elson, L. Wood, S. Shah, A. Stephenson, ''et al.''; The effect of sunitinib on primary renal cell carcinoma and facilitation of subsequent surgery; J Urol., 187 (5) (2012), pp. 1548–1554</li> |
<li><span id='bib0140'></span> | <li><span id='bib0140'></span> | ||
| − | [[#bib0140|10]] | + | [[#bib0140|10]] A. Bex, C. Blank, W. Meinhardt, H. van Tinteren, S. Horenblas, J. Haanen; A phase II study of presurgical sunitinib in patients with metastatic clear‐cell renal carcinoma and the primary tumor in situ; Urology., 78 (4) (2011), pp. 832–837</li> |
<li><span id='bib0145'></span> | <li><span id='bib0145'></span> | ||
| − | [[#bib0145|11]] | + | [[#bib0145|11]] T. Powles, I. Kayani, C. Blank, S. Chowdhury, S. Horenblas, J. Peters, ''et al.''; The safety and efficacy of sunitinib before planned nephrectomy in metastatic clearcell renal cancer; Ann Oncol., 22 (5) (2011), pp. 1041–1047</li> |
<li><span id='bib0150'></span> | <li><span id='bib0150'></span> | ||
| − | [[#bib0150|12]] | + | [[#bib0150|12]] T. Powles, C. Blank, S. Chowdhury, S. Horenblas, J. Peters, J. Shamash, ''et al.''; The outcome of patients treated with sunitinib prior to planned nephrectomy in metastatic clear cell renal cancer; Eur Urol., 60 (3) (2011), pp. 448–454</li> |
<li><span id='bib0155'></span> | <li><span id='bib0155'></span> | ||
| − | [[#bib0155|13]] | + | [[#bib0155|13]] Cowey CL1, C. Amin, R.S. Pruthi, E.M. Wallen, M.E. Nielsen, G. Grigson, ''et al.''; Neoadjuvant clinical trial with sorafenib for patients with stage II or higher renal cell carcinoma; J Clin Oncol., 28 (9) (2010), pp. 1502–1507</li> |
<li><span id='bib0160'></span> | <li><span id='bib0160'></span> | ||
| − | [[#bib0160|14]] | + | [[#bib0160|14]] E. Jonasch, C.G. Wood, S.F. Matin, S.M. Tu, L.C. Pagliaro, P.G. Corn, ''et al.''; Phase II presurgical feasibility study of bevacizumab in untreated patients with metastatic renal cell carcinoma; J Clin Oncol., 27 (25) (2009), pp. 4076–4081</li> |
<li><span id='bib0165'></span> | <li><span id='bib0165'></span> | ||
| − | [[#bib0165|15]] | + | [[#bib0165|15]] B. Escudier; Benefit of cytoreductive nephrectomy in metastatic RCC: Do we learn from retrospective studies and small prospective studies?; Ann Oncol, 22 (5) (2011), pp. 995–996</li> |
<li><span id='bib0170'></span> | <li><span id='bib0170'></span> | ||
| − | [[#bib0170|16]] | + | [[#bib0170|16]] Immediate surgery or surgery after sunitinib malate in treating patients with metastatic kidney cancer. US National Institutes of Health Web. Disponível em: http://Clinicaltrials.gov/ct2/show/NCT01099423</li> |
<li><span id='bib0175'></span> | <li><span id='bib0175'></span> | ||
| − | [[#bib0175|17]] | + | [[#bib0175|17]] E.M. Ibrahim, G.A. Kazkaz, K.M. Abouelkhair, A.M. Bayer, O.A. Elmasri; Sunitinib adverse events in metastatic renal cell carcinoma: A meta‐analysis; Int J Clin Oncol, 18 (6) (2013), pp. 1060–1069</li> |
<li><span id='bib0180'></span> | <li><span id='bib0180'></span> | ||
| − | [[#bib0180|18]] | + | [[#bib0180|18]] G.L. Shaw, M. Hussain, R. Nair, J. Bycroft, L. Beltran, J.S. Green, ''et al.''; Performing cytoreductive nephrectomy following targeted sunitinib therapy for metastatic renal cell carcinoma: A surgical perspective; Urol Int., 89 (1) (2012), pp. 83–88</li> |
</ol> | </ol> | ||
Latest revision as of 11:29, 11 April 2017
Resumo
Introdução
Ao longo das últimas 3 décadas o papel da nefrectomia nos doentes com carcinoma de células renais (CCR) metastizado tem sofrido várias alterações, resultado da implementação das terapêuticas sistémicas como as citocinas (IL‐2, INF‐α) e mais recentemente dos inibidores da angiogénese e da via mTor. Utilizando um caso clínico como ponto de partida, realizámos uma revisão da literatura com o objetivo de questionar se existe ainda lugar para nefrectomia citorredutora numa «era» claramente assumida pelas terapêuticas sistémicas.
Caso clínico
Apresentamos o caso de um doente de 53 anos, com o diagnóstico de CCR metastizado e que foi submetido a nefrectomia citoredutora por via laparoscópica após realização de terapêutica neoadjuvante com sunitinib.
Discussão
Apesar da nefrectomia citoredutora ter sido associada a um aumento da sobrevida global dos doentes com CCR metastizado quando complementada pela imunoterapia (INF‐α, Il‐2), a morbilidade e mortalidade inerente à cirurgia e os resultados demonstrados pelos esquemas de monoterapia com os inibidores da angiogénese, entre eles o sunitinib, lançaram o debate sobre o verdadeiro benefício da nefrectomia. Neste sentido têm sido realizados estudos que procuram demonstrar se existe benefício em utilizar o sunitinib antes e/ou após a cirurgia ou apenas em esquema de monoterapia. Foi demonstrado que o sunitinib neoadjuvante permite não só diminuir a dimensão do tumor renal primário (CCR – células claras) com benefício na sobrevida global dos doentes, como permite detetar precocemente os doentes refratários à terapêutica sistémica e que provavelmente não beneficiarão da cirurgia.
Conclusão
Os estudos preliminares indicam que o tratamento dos doentes com CCR metastizado dependerá provavelmente de uma abordagem que inclua quer a nefrectomia citorredutora quer as terapêuticas sistémicas.
Abstract
Introduction
Over the past three decades, nephrectomy for the treatment of patients with metastatic renal cell carcinoma (mRCC) has undergone several modifications, resulting from the implementation of systemic therapies, such as those using cytokines (IL‐2 and IFN‐α), and more recently molecular targeted therapies, such as inhibitors of angiogenesis and mTor. Using a case report as a starting point, we conducted a literature review to determine whether there is still a place for cytorreductive nephrectomy in an “era” that sees the increasing use of systemic therapies.
Clinical case
We present a 53‐year‐old patient who was diagnosed with metastatic RCC and underwent laparoscopic cytorreductive nephrectomy after completion of neo‐adjuvant therapy with Sunitinib.
Discussion
Although cytorreductive nephrectomy is associated with an increase in the overall survival of patients with metastatic RCC when it is accompanied by immunotherapy (INF‐α and IL‐2), the morbidity and mortality inherent to surgery and the positive results obtained by monotherapy regimens, including inhibitors of angiogenesis, such as Sunitinib, has launched a debate on the true benefit of nephrectomy. With this in mind, we analised studies to evaluate whether there is a benefit in administering Sunitinib before and/or after surgery, or just as part of a monotherapy regimen. We found that neo‐adjuvant Sunitinib therapy not only reduced the size of the primary renal tumor, with an increase in the overall survival of the patients, but also allowed the early detection of patients who were refractory to systemic therapy and not likely to benefit from surgery.
Conclusion
Preliminary studies indicate that treatment of patients with metastatic RCC will probably depend on an approach that includes both cytorreductive nephrectomy and systemic therapies
Palavras‐chave
Nefrectomia citorredutora ; Carcinoma das células renais metastizado ; Sunitinib ; Sobrevida global ; Prognóstico
Keywords
Cytorreductive nephrectomy ; Metastatic renal cell carcinoma ; Sunitinib ; Overal survival ; Prognosis
Introdução
Entre todas as neoplasias malignas urológicas o carcinoma de células renais (CCR) é considerado o mais letal1 .
Histologicamente, 85% dos CCR são de células claras e na altura do diagnóstico aproximadamente 20‐30% dos doentes já apresenta doença síncrona metastática, com mau prognóstico2 . Adicionalmente, dos doentes nefrectomizados, cerca de 20% vão recidivar e desenvolver metástases durante o período de follow‐up3 .
A abordagem terapêutica do CCR metastizado tem sofrido muitas transformações ao longo das últimas décadas, resultado do aparecimento de novas terapêuticas sistémicas. Inicialmente, a nefrectomia citorredutora tinha apenas uma indicação paliativa, não se definindo nenhum benefício na sobrevida global. No fim da década de 90, na era das citocinas (INF‐α, IL‐2), demonstrou‐se o benefício da cirurgia em termos de sobrevida global, quando realizada em doentes de baixo risco e antes da terapêutica sistémica. Nos últimos anos, novos fármacos, nomeadamente os inibidores da angiogénese (sunitinib, sorafenib, etc.) e inibidores da via mTOR (temsirolimus, everolimus) impuseram‐se pelo seu impacto positivo na sobrevivência dos doentes, substituindo quase por completo as citocinas e questionando novamente o interesse da nefrectomia citorredutora.
Caso clínico
Apresentamos o caso de um doente do sexo masculino, 53 anos, residente na Flórida, Estados Unidos da América (EUA), aparentemente saudável e sem antecedentes pessoais relevantes. Observado no serviço de urgência do Hospital Doctor Medical Center of Modesto no contexto de um quadro clínico de afasia e desorientação. Por suspeita de intoxicação etanólica fez o despiste toxicológico que se revelou negativo e realizou ressonância magnética cerebral (RMN) que revelou uma massa do córtex frontal à esquerda com 5 cm de maior diâmetro (fig. 1 ).
|
|
|
Figura 1. Identifica‐se lesão com 5 cm de maior eixo no córtex frontal à esquerda em cortecoronal da ressonância magnética. |
Foi submetido a uma craniotomia temporoparietal esquerda com biópsia e excisão da massa que revelou um CCR, de células claras, Furhman 2, com o estadiamento pTX NX M1. Neste contexto fez uma Tomografia Axial Computorizada (TAC) toraco‐abdomino‐pélvica (T‐A‐P) que demonstrou um volumoso tumor renal à direita, com cerca de 11 cm de maior diâmetro, múltiplas adenopatias lomboaórticas, no entanto, sem aparentes depósitos secundários pulmonares, hepáticos ou ósseos (tivemos acesso ao relatório do exame, sem imagens). Foi referenciado ao departamento de oncologia onde iniciou terapêutica sistémica com sunitinib, tendo realizado apenas um ciclo (esquema 4/2, 50 mg/dia).
Por motivos económicos, o doente abandona o tratamento e o hospital em agosto de 2013. Passa a ser acompanhado em Portugal, no Hospital Prof. Doutor Fernando Fonseca, e finalmente em fevereiro de 2014 (6 meses depois) é observado em consulta de oncologia e reestadiado. A TAC T‐A‐P revelou uma massa renal com 10,5 cm de maior eixo à direita, com adenopatias lomboaórticas hilares e interaortocava, ainda que sem evidência de metastização pulmonar, hepática ou óssea (fig. 2 ).
|
|
|
Figura 2. TAC toraco‐abdomino‐pélvica de reestadiamento, realizada em Portugal, 6 meses após a realização de um ciclo de, sunitinib nos EUA. |
O doente encontrava‐se assintomático, sem hematúria e com bom estado geral. Após discussão multidisciplinar optou‐se por realizar mais 2 ciclos de sunitinib (50 mg/dia 4 semanas com interrupção de 2 semanas) de forma a avaliar a resposta em termos de redução da dimensão do tumor renal primário e do bulking ganglionar justa‐hilar e justa‐Psoas. A nova TAC revelou diminuição da dimensão da massa renal para 9 cm x 7 cm e diminuição do conglomerado adenopático hilar (fig. 3 ).
|
|
|
Figura 3. a) Tumor do polo inferior do rim direito, com 9 cm x 7 após realização de sunitinib (2 ciclos), b) conglomerado adenopático hilar e justa, Psoas. |
Pela aparente ressecabilidade cirúrgica, idade do doente, score do Memorial Sloan‐Kettering Cancer Center (MSKCC) e boa resposta à terapêutica com sunitinib, optou‐se pela realização da nefrectomia radical citorredutora por via laparoscópica que decorreu sem intercorrências. Na TAC de reestadiamento identificou‐se metastização pulmonar de novo e progressão de doença ganglionar e optou‐se pela reintrodução de sunitinib, 3 ciclos, 37,5 mg/dia (dosagem reduzida no contexto de hipotiroidismo). Atualmente aguarda TAC de reestadiamento, no entanto, sabemos que pela agressividade do tumor (Furhman 4) o prognóstico não é favorável fig. 4 .
|
|
|
Figura 4. Nefrectomia citorredutora laparoscópica direita. a) Laqueação do ureter, b) isolamento da veia renal direita, c) laqueação da veia gonadal veia renal e artéria renal, d) peça de nefrectomia radical. Anatomia patológica: CCR, células claras, Furhman 4, pT3aN2, margem hilar ocupada e restantes margens livres. |
Discussão
Historicamente, a nefrectomia citorredutora no CCR metastizado baseou‐se no fenómeno imunológico raro, mas descrito, de regressão espontânea das metástases após a nefrectomia e na incapacidade das citocinas sistémicas induzirem uma resposta no tumor renal primário4 .
Inicialmente foi utilizada como uma ferramenta meramente paliativa, no entanto, com o aparecimento das citocinas sistémicas, nomeadamente o INF‐α sustentado por 2 estudos prospetivos, o Southwest Oncology Group (SWOG) 8.949 e o European Organization for Research and Treatment of Cancer (EORTC) 30.947, conseguiu‐se demonstrar que a nefrectomia associada ao INF‐α adjuvante aumentava em cerca de 6 meses a sobrevida média global do doente, quando comparado com o INF‐ α isoladamente5 ; 6 . Mais tarde demonstrou‐se que a IL‐2 estava associada a um ganho de sobrevida ainda maior (cerca de 4 meses em relação ao INF‐α). De referir que nestes estudos apenas se contemplavam doentes de baixo risco (bom estado geral, metastização única pulmonar e com capacidade para fazer terapêutica adjuvante) e que não preenchiam nenhum dos critérios de estratificação de alto risco definidos pela MSKCC.
Com aparecimento dos novos fármacos, nomeadamente os inibidores da angiogénese e os inibidores da via mTOR, a abordagem ao CCR metastizado modificou‐se e o interesse da nefrectomia foi novamente questionado.
O sunitinib faz parte do grupo dos inibidores da tirosina quinases nomeadamente o VEGF, PDGFR, VEGFR, c‐KIT e FLT‐3, apresentando uma atividade antitumoral e antiangiogénica. Conseguiu colocar para segundo plano a utilização do INF‐α na monoterapia do CCR metastizado através de um estudo de fase III, onde se demonstrou que a sua utilização em doentes de risco baixo/intermédio, para além de segura, estava associada a um aumento de sobrevida média em cerca de 6 meses (11 meses vs. 5 meses; p < 0,000001)7 .
Atualmente, a terapêutica sistémica dirigida ocupa a linha da frente na abordagem terapêutica destes doentes e nesse sentido questionamos: qual o papel da nefrectomia citorredutora no CCR metastizado? Deve ser feita? Se sim, em que momento?
A nefrectomia citorredutora tem sido muito contestada argumentando‐se o atraso que condiciona na implementação da terapêutica sistémica, permitindo a progressão da doença, mas também a morbilidade e mortalidade associada.
No entanto, neste momento, o enquadramento da nefrectomia citorredutora nas atuais guidelines está dependente de uma série de estudos prospetivos que se encontram em curso.
Um deles é o CARMENA8 , que inclui mais de 1.000 doentes com CCR tipo células claras, metastizado, com boa performance status e onde se compara a sobrevida global na terapêutica isolada com sunitinib vs. nefrectomia citorredutora complementada com sunitinib adjuvante, no entanto, os resultados só serão divulgados para meados de 2016/2017.
No contexto do caso clínico apresentado, também já se iniciaram estudos que procuram demonstrar o interesse da utilização dos inibidores da angiogénese, nomeadamente o sunitinib, como terapêutica neoadjuvante.
Várias vantagens foram associadas a este esquema terapêutico, nomeadamente a rapidez da implementação da terapêutica sistémica, permitindo poupar o tempo perdido com o planeamento, realização e recuperação da cirurgia, evitando assim a progressão da doença.
Outra vantagem está na possibilidade de diminuir o tumor renal primário e eventualmente converter tumores irressecáveis em tumores ressecáveis.
De acordo com a literatura, verifica‐se que a utilização de sunitinib (pelo menos 2 ciclos, 50 mg) previamente à nefrectomia citorredutora, em doentes com CCR metastizados, de risco baixo/intermédio (critérios do MSKCC), parece ser uma abordagem segura, associada a uma diminuição em média do tumor renal primário de aproximadamente 10%, contribuindo para uma maior sobrevida global do doente. Quanto maior for a resposta no tumor renal primário e nos depósitos metastáticos melhor o prognóstico em termos de sobrevida global do doente9 ; 10 ; 11 ; 12 . Para além do sunitinib, também estão descritos estudos com a utilização de sorafenib (400 mg 2 x/dia durante 4 semanas) e bevacizumab (10 mg/kg, uma toma de 2/2 semanas durante 8 semanas) com intuito neoadjuvante no CCR metastizado, mas com resultados inferiores em termos de sobrevida global e redução da dimensão média do tumor renal primário13 ; 14 .
Segundo Powles et al. nos doentes de risco baixo/intermédio submetidos a sunitinib neoadjuvante e nefrectomia citorredutora a sobrevida global foi de 26 meses comparando com apenas 9 meses nos doentes de alto risco 12 .
É importante referir que se constatou que a interrupção da terapêutica com sunitinib condicionada pela cirurgia (entre 3‐4 semanas) e que procura evitar complicações como o atraso na cicatrização esteve associada a progressão da doença em cerca de 33% dos doentes, no entanto, com estabilização após a sua reintrodução, em cerca de 70% dos casos12 . Curiosamente, este facto é reconhecido e deixa a dúvida se a cirurgia não será um obstáculo terapêutico.
A realização da terapêutica neoadjuvante pode estar associada a outra vantagem potencial, nomeadamente, identificar os doentes refratários (segundo alguns estudos até cerca de 19%) e nesse sentido evitar a realização da nefrectomia citorredutora, que parece não trazer benefício nestes doentes de alto risco12 . No entanto, esta situação é controversa, na medida que existem argumentos a favor de que a própria nefrectomia aumenta a resposta à terapêutica sistémica, diminuindo assim o número de doentes refratários15 .
Por fim, está a decorrer um estudo prospetivo de fase III(SURTIME ) 16 que pretende comparar, em termos de sobrevivência livre de doença, a realização de nefrectomia logo após o diagnóstico vs. a nefrectomia só após a realização de 3 ciclos de sunitinib. Este estudo virá complementar o estudo CARMENA e permitir‐nos‐á tirar mais conclusões.
Em termos cirúrgicos, a nefrectomia citorredutora via aberta ou laparoscópica após terapêutica sistémica dirigida é tecnicamente mais difícil, condicionada por aumento da fibrose dos tecidos, neovascularização e perda dos planos anatómicos, resultando em maiores perdas sanguíneas, maior duração da cirurgia e maior número de dias de internamento. A toxicidade do sunitinib foi consistente com o seu perfil de segurança. Para qualquer grau de toxicidade os efeitos adversos mais frequentes são o rash cutâneo, diarreia, fadiga e mucosite. Em termos perioperatórios, a mielosupressão, nomeadamente anemia e trombocitopenia, podem implicar transfusão de elementos sanguíneos pré‐operatórios; a hipertensão, prolongamento do intervalo QT e disfunção ventricular esquerda podem ter implicações anestésicas e como tal recomenda‐se a realização de um ecocardiograma pré‐operatório17 . Ainda assim, é uma cirurgia exequível e com complicações semelhantes quando comparada com uma nefrectomia radical num doente não metastizado e não submetido a terapêutica neoadjuvante18 .
Conclusão
O debate entre a importância e o papel da nefrectomia citorredutora vai manter‐se enquanto não surgirem novos resultados dos vários estudos em curso. Até lá, a nefrectomia citorredutora deve ser recomendada, se exequível, nos doentes com CCR metastizado, incluídos no grupo de risco baixo e intermédio segundo o MSKCC. Os resultados apresentados na literatura da utilização dos inibidores da angiogénese, nomeadamente o sunitinib, com intuito neoadjuvante, nos doentes com CCR metastizado, ainda permanecem insuficientes para que se possa adotar de forma estandardizada.
Responsabilidades éticas
Proteção de pessoas e animais
Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados
Os autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escrito
Os autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Bibliografia
- 1 S. Lam, O. Shvarts, J.T. Leppert, A.S. Figlin; Belldegrun Renal cell carcinoma 2005: New frontiers in staging, prognostication and targeted molecular therapy; J Urol, 173 (6) (2005), pp. 1853–1862
- 2 K. Gupta, J.D. Miller, J.Z. Li, M.W.C. Russell; Charbonneau epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): A literature review; Cancer Treat Rev, 34 (2008), pp. 193–205
- 3 U. Athar, T.C. Gentile; Treatment options for metastatic renal cell carcinoma: A review; Can J Urol, 15 (2008), pp. 3954–3966
- 4 B.I. Rini, S.C. Campbell, B. Escudier; Renal cell carcinoma; Lancet., 373 (9669) (2009), pp. 1119–1132
- 5 R.C. Flanigan, S.E. Salmon, B.A. Blumenstein, S.I. Bearman, V. Roy, P.C. McGrath, et al.; Nephrectomy followed by interferon alfa‐2b compared with interferon alfa‐2b alone for metastatic renal cancer; N Engl J Med, 345 (2001), pp. 1655–1659
- 6 M.M. Walther, R.B. Alexander, G.H. Weiss, D. Venzon, A. Berman, H.I. Pass, et al.; Cytoreductive surgery prior to interleukin‐2‐based therapy in patients with metastatic renal cell carcinoma; Urology, 42 (1993), pp. 250–258
- 7 Overall survival with sunitinib versus interferon (IFN)‐alfa as first‐line treatment of metastatic renal cell carcinoma (mRCC); J Clin Oncol (Meeting Abstracts), 26 (15) (2008), p. 5024
- 8 Clinical trial to assess the importance of nephrectomy (CARMENA), US National Institutes of Health, Disponível em: http://clinicaltrials.gov/ct2/show/NCT00930033
- 9 B.I. Rini, J. Garcia, P. Elson, L. Wood, S. Shah, A. Stephenson, et al.; The effect of sunitinib on primary renal cell carcinoma and facilitation of subsequent surgery; J Urol., 187 (5) (2012), pp. 1548–1554
- 10 A. Bex, C. Blank, W. Meinhardt, H. van Tinteren, S. Horenblas, J. Haanen; A phase II study of presurgical sunitinib in patients with metastatic clear‐cell renal carcinoma and the primary tumor in situ; Urology., 78 (4) (2011), pp. 832–837
- 11 T. Powles, I. Kayani, C. Blank, S. Chowdhury, S. Horenblas, J. Peters, et al.; The safety and efficacy of sunitinib before planned nephrectomy in metastatic clearcell renal cancer; Ann Oncol., 22 (5) (2011), pp. 1041–1047
- 12 T. Powles, C. Blank, S. Chowdhury, S. Horenblas, J. Peters, J. Shamash, et al.; The outcome of patients treated with sunitinib prior to planned nephrectomy in metastatic clear cell renal cancer; Eur Urol., 60 (3) (2011), pp. 448–454
- 13 Cowey CL1, C. Amin, R.S. Pruthi, E.M. Wallen, M.E. Nielsen, G. Grigson, et al.; Neoadjuvant clinical trial with sorafenib for patients with stage II or higher renal cell carcinoma; J Clin Oncol., 28 (9) (2010), pp. 1502–1507
- 14 E. Jonasch, C.G. Wood, S.F. Matin, S.M. Tu, L.C. Pagliaro, P.G. Corn, et al.; Phase II presurgical feasibility study of bevacizumab in untreated patients with metastatic renal cell carcinoma; J Clin Oncol., 27 (25) (2009), pp. 4076–4081
- 15 B. Escudier; Benefit of cytoreductive nephrectomy in metastatic RCC: Do we learn from retrospective studies and small prospective studies?; Ann Oncol, 22 (5) (2011), pp. 995–996
- 16 Immediate surgery or surgery after sunitinib malate in treating patients with metastatic kidney cancer. US National Institutes of Health Web. Disponível em: http://Clinicaltrials.gov/ct2/show/NCT01099423
- 17 E.M. Ibrahim, G.A. Kazkaz, K.M. Abouelkhair, A.M. Bayer, O.A. Elmasri; Sunitinib adverse events in metastatic renal cell carcinoma: A meta‐analysis; Int J Clin Oncol, 18 (6) (2013), pp. 1060–1069
- 18 G.L. Shaw, M. Hussain, R. Nair, J. Bycroft, L. Beltran, J.S. Green, et al.; Performing cytoreductive nephrectomy following targeted sunitinib therapy for metastatic renal cell carcinoma: A surgical perspective; Urol Int., 89 (1) (2012), pp. 83–88
Document information
Published on 11/04/17
Licence: Other
Share this document
Keywords
claim authorship
Are you one of the authors of this document?