(Update figure 2) (Tag: Visual edit) |
|||
| Line 57: | Line 57: | ||
[[File:Draft_Sanchez_Soto_190797733_4565_Fig1-JPG.jpg|thumb|centre]] | [[File:Draft_Sanchez_Soto_190797733_4565_Fig1-JPG.jpg|thumb|centre]] | ||
| − | Figura 1. Porcentaje de hinchamiento de los aerogeles tras una y dos deposiciones (eje izquierdo). Porcentaje en peso de PEG incorporado en la estructura después de dos deposiciones (eje derecho) | + | Figura 1. Porcentaje de hinchamiento de los aerogeles tras una y dos deposiciones (eje izquierdo). Porcentaje en peso de PEG incorporado en la estructura después de dos deposiciones (eje derecho). |
En la Figura 2 se muestran las curvas termogravimétricas de los aerogeles tras una y dos deposiciones de PEG. La temperatura de inicio de descomposición (Tonset) del PEG puro fue de 385 °C, mientras que la temperatura en la que ocurrió la máxima velocidad de pérdida de masa (Tdmax) fue de 412 °C. La Tonset se utilizó para cuantificar la cantidad de PEG incorporada dentro de la estructura del aerogel tras una y dos deposiciones para las dos composiciones analizadas. | En la Figura 2 se muestran las curvas termogravimétricas de los aerogeles tras una y dos deposiciones de PEG. La temperatura de inicio de descomposición (Tonset) del PEG puro fue de 385 °C, mientras que la temperatura en la que ocurrió la máxima velocidad de pérdida de masa (Tdmax) fue de 412 °C. La Tonset se utilizó para cuantificar la cantidad de PEG incorporada dentro de la estructura del aerogel tras una y dos deposiciones para las dos composiciones analizadas. | ||
| Line 69: | Line 69: | ||
Uno de los factores clave para aumentar la conductividad en electrolitos sólidos, como el sistema PEG-LiTFSI, es la reducción de la cristalinidad. Esto se debe a que la conducción en estado sólido se debe a la parte amorfa del polímero [6] La tabla 1 muestra los valores de cristalinidad, calculados por DSC después de borrar la historia térmica de la muestra y normalizando el valor real de PEG absorbido de acuerdo a los resultados de TGA. El PEG se caracteriza por una muy elevada cristalinidad, del 90.1% en este caso. Cuando el polímero se infiltró en las matrices porosas de los aerogeles, su cristalinidad disminuyó ligeramente, probablemente debido a la interrupción de la organización cristalina por interacciones con la matriz. En presencia de LiTFSI, se produjo una reducción adicional de la cristalinidad, debido tanto al efecto de la matriz como a la propia incorporación de la sal de litio [7] Los valores de cristalinidad obtenidos fueron de 79.1% y 37.1% para el aerogel G5T2C2, y de 85.7% y 20.4% para G5T2C5, con y sin sal de litio, respectivamente (Tabla 1). | Uno de los factores clave para aumentar la conductividad en electrolitos sólidos, como el sistema PEG-LiTFSI, es la reducción de la cristalinidad. Esto se debe a que la conducción en estado sólido se debe a la parte amorfa del polímero [6] La tabla 1 muestra los valores de cristalinidad, calculados por DSC después de borrar la historia térmica de la muestra y normalizando el valor real de PEG absorbido de acuerdo a los resultados de TGA. El PEG se caracteriza por una muy elevada cristalinidad, del 90.1% en este caso. Cuando el polímero se infiltró en las matrices porosas de los aerogeles, su cristalinidad disminuyó ligeramente, probablemente debido a la interrupción de la organización cristalina por interacciones con la matriz. En presencia de LiTFSI, se produjo una reducción adicional de la cristalinidad, debido tanto al efecto de la matriz como a la propia incorporación de la sal de litio [7] Los valores de cristalinidad obtenidos fueron de 79.1% y 37.1% para el aerogel G5T2C2, y de 85.7% y 20.4% para G5T2C5, con y sin sal de litio, respectivamente (Tabla 1). | ||
| − | Tabla 1. Cristalinidad (Xc) y porosidad de los aerogeles antes y después de dos infiltraciones con PEG-LiTFSI | + | Tabla 1. Cristalinidad (Xc) y porosidad de los aerogeles antes y después de dos infiltraciones con PEG-LiTFSI. |
{| style="width: 100%;margin: 1em auto 0.1em auto;border-collapse: collapse;" | {| style="width: 100%;margin: 1em auto 0.1em auto;border-collapse: collapse;" | ||
| Line 116: | Line 116: | ||
Figura 4 a) Gráfica de Nyquist de los dos aerogeles a 30 °C; b) gráficos de barras de la conductividad iónica de los dos aerogeles infiltrados a 30 °C y 60 °C. | Figura 4 a) Gráfica de Nyquist de los dos aerogeles a 30 °C; b) gráficos de barras de la conductividad iónica de los dos aerogeles infiltrados a 30 °C y 60 °C. | ||
| − | Como era esperable, la conductividad iónica aumentó al doble al subir la temperatura de 30ºC a 60 °C, (figura 4b), por alcanzarse la de fusión del PEG. A pesar de la complejidad en el proceso de difusión, el compuesto G5T2C2, evidenció una mayor conductividad iónica volumétrica en comparación con la G5T2C5 que posee más cantidad de arcilla en la estructura. El valor máximo de conductividad alcanzado a temperatura ambiente fue de 3 x 10⁻⁶ S/cm | + | Como era esperable, la conductividad iónica aumentó al doble al subir la temperatura de 30ºC a 60 °C, (figura 4b), por alcanzarse la de fusión del PEG. A pesar de la complejidad en el proceso de difusión, el compuesto G5T2C2, evidenció una mayor conductividad iónica volumétrica en comparación con la G5T2C5 que posee más cantidad de arcilla en la estructura. El valor máximo de conductividad alcanzado a temperatura ambiente fue de 3 x 10⁻⁶ S/cm.''' |
== <big>'''4. Conclusiones'''</big> == | == <big>'''4. Conclusiones'''</big> == | ||
Revision as of 12:51, 8 April 2025
1. Introducción
Debido a sus altas densidades de energía y potencia, las baterías de litio-metal tienen un gran interés para los sistemas de nueva generación. Sin embargo, el uso de litio como ánodo plantea problemas de seguridad, particularmente por la formación de dendritas y el potencial descontrol térmico causado por acumulación de calor [1]. Dos de los componentes clave en estos sistemas son el electrolito y el separador, cuyo papel es evitar el contacto entre electrodos y por tanto, los cortocircuitos. Los separadores comúnmente utilizados están hechos de polipropileno o polietileno, siendo propensos a fusión o deformación entorno de 120°C, lo que puede ocasionar contacto entre los dos electrodos [2]. Un separador ideal debería ser ignífugo, poseer buena resistencia termo-mecánica, humectarse con el electrolito, asegurar un contacto adecuado con los electrodos y mantener una fuerte conductividad iónica mientras proporcionan aislamiento eléctrico [3]. Por otro lado, en aras de alcanzar una mayor seguridad, uno de los objetivos en baterías y supercondensadores es el reemplazo de los electrólitos líquidos por sólidos. Dentro de los electrolitos sólidos poliméricos (SPE), uno de los más empleados, es el polietilen-glicol (PEG) ya que es capaz de disolver un gran número de sales de litio y presenta una amplia estabilidad electroquímica. En estos sistemas la conducción iónica se produce gracias al movimiento molecular especialmente producido en la fase amorfa. La limitación del PEG estriba en su alta cristalinidad, limitadas propiedades mecánicas y relativamente baja temperatura de uso, razones por la cuales se están explorando otros sistemas. Recientemente el empleo de aerogeles se ha explorado como una posible alternativa. La alta porosidad que distingue a este tipo de materiales puede facilitar el transporte iónico, manteniendo a su vez la estabilidad termo-mecánica. Estudios previos han logrado una conductividad iónica de 6 × 10-4 S/cm usando un aerogel de sílice como soporte para un PEG reticulado [4]. Así el objetivo de este trabajo es diseñar un sistema poroso, orientado uniaxialmente, con conductividad iónica intrínseca, y activado con un SPE infiltrado en la porosidad. Mediante la creación de canales conductivos lineales y combinando una alta absorción de electrolito con conductividad iónica intrínseca es posible mejorar el rendimiento global de estos sistemas.
2. Experimental
2.1. Materiales y su preparación
Como material base se empleó gelatina (G) tipo B, con una fuerza de gel de 220-240 Bloom. El ácido tánico (T) fue suministrado por Merck (Barcelona) y se empleó montmorillonita (C), grado PGW, ρ=2.6 g/cm³ de Nanocor (USA). El PEG con peso molecular de 8000 g/mol se obtuvo de ThermoFisher (Alemania). La sal de Litio bis(trifluorometanosulfonil) imida (LiTFSI) se adquirió a Sigma Aldrich. Los geles precursores se prepararon dispersando por separado 5 g de gelatina y la cantidad necesaria de arcilla (2 o 5 g.) en 40 mL de agua desionizada, disolviendo por otro lado 2 g de ácido tánico (TA) en 20 mL de agua [5]. Las soluciones de gelatina y ácido tánico se regularon a PH=10 con NaOH homogeneizando la mezcla a 9000 rpm. Los porcentajes de gelatina (G), ácido tánico (T) y arcilla (C) se cuantifican en relación a su peso en 100 ml de agua. Por ejemplo, el aerogel G5C5T1 está formado por 5 gr. de gelatina, 5 gr. de arcilla y 1 gr. de ácido tánico. Para lograr orientación axial, se vertieron las soluciones sobre un molde cilindro con una placa de cobre en la base, en contacto con nitrógeno líquido (-196 °C) y posteriormente se liofilizaron a 0.02 mbar y -80 ºC. Los aerogeles obtenidos se recortaron a un grosor de aproximadamente 700 micras y se sumergieron en una solución de PEG al 25% en etanol, con o sin LiTFSI - añadido con una relación molar óxido de etileno /iones litio [EO]/[Li] de 18- durante 24 horas (1ª deposición). Las muestras se secaron al vacío a 90 mbar a 50 °C durante 3 horas, se pesaron y se sumergieron nuevamente en la solución realizando una 2ª deposición, siguiendo el mismo procedimiento.
2.2. Caracterización.
La absorción de PEG se obtuvo midiendo el peso final de las muestras tras 24 horas de inmersión en la solución de PEG/etanol y comparándolo con el inicial. El porcentaje de PEG añadido, se determinó por gravimetría según la ecuación (2), donde Pi es el peso del aerogel sin infiltrar y Pf es el peso del aerogel tras 24 horas de infiltración y posterior secado en horno de vacío a 50 °C durante 3 horas para evaporar el etanol residual.
|
|
(1) |
El análisis termogravimétrico (Mettler Toledo TGA/DSC 1) se empleó también para confirmar la cantidad de PEG absorbido y asimismo para determinar la estabilidad térmica de los compuestos. Aproximadamente 10 mg de las muestras se calentaron desde 30 ºC hasta 600 ºC a velocidad de 10ºC/min en atmósfera de nitrógeno. Las transiciones térmicas se analizaron mediante calorimetría diferencial de barrido (DSC- Q2000 TA Instruments). Aproximadamente 5 mg de las muestras se encapsularon y se sometieron a una tasa de calentamiento de 10 °C/min entre -50 y 90 °C, en una atmósfera inerte de nitrógeno. El grado de cristalinidad (Xc), se determinó mediante la ecuación (3), donde ∆Hm es la entalpía de fusión, ∆Hcc la entalpía de cristalización en frío, ∆Hm*es la entalpía de fusión ideal para un PEG 100% cristalino (197 J/g) [8], y fp es la fracción de PEG calculada previamente.
|
|
(2) |
La densidad aparente (ρb) de los aerogeles se obtuvo dividiendo el peso de las muestras cilíndricas obtenidas (d=30 mm, h =25 mm.) entre su volumen. La densidad esqueletal (ρs) se midió con un picnómetro de helio (Micromeritics AccuPyc 1330). El ratio entre ambas es la densidad relativa (ρr) que permite calcular la porosidad de los aerogeles según la ecuación (1).
|
|
(3) |
La conductividad iónica de los electrolitos de aerogel se midió utilizando un equipo Biologic VMP300 con un módulo de impedancia de corriente alterna (AC). Las mediciones se realizaron a 0 V respecto al potencial de circuito abierto (OCP), dentro de un rango de frecuencia de 1 MHz a 100 MHz. Las muestras se colocaron en una celda electroquímica con dos separadores de acero inoxidable operando a 30 y 60 °C.
3. Resultados
Los aerogeles que se estudiaron fueron los denominados G5T2C2 y G5T2C5, donde cada letra representa el material empleado y el número son los gramos en la composición final. Siendo compuestos porosos, la primera determinación consistió en averiguar la absorción de electrolito. Ambas composiciones se sumergieron en una solución de PEG al 25% en etanol durante 24 horas, resultando en un hinchamiento del 586% ± 50 para G5T2C5 y 740 % ± 1 para G5T2C2. Durante el segundo proceso de deposición, el hinchamiento aumentó respectivamente un 17% y un 11%, Después de la segunda deposición, los resultados de gravimetría (Figura 1) indicaron que las cantidades máximas PEG absorbidas fueron de 60 ± 1% y 57 ± 8% respectivamente.
Figura 1. Porcentaje de hinchamiento de los aerogeles tras una y dos deposiciones (eje izquierdo). Porcentaje en peso de PEG incorporado en la estructura después de dos deposiciones (eje derecho).
En la Figura 2 se muestran las curvas termogravimétricas de los aerogeles tras una y dos deposiciones de PEG. La temperatura de inicio de descomposición (Tonset) del PEG puro fue de 385 °C, mientras que la temperatura en la que ocurrió la máxima velocidad de pérdida de masa (Tdmax) fue de 412 °C. La Tonset se utilizó para cuantificar la cantidad de PEG incorporada dentro de la estructura del aerogel tras una y dos deposiciones para las dos composiciones analizadas.
Figura 2. Pérdida de peso por TGA del polímero PEG puro y del aerogel: G5T2C2 tras 1 y 2 deposiciones con PEG y tras dos 2 deposiciones con PEG y LiTFSI.
Al normalizar la cantidad de PEG con respecto al peso seco de la muestra se encontró que tras una deposición, la cantidad de polímero incorporada en el aerogel G5T2C2 fue del 54.3%, mientras que tras dos deposiciones fue del 56.4%, y para el compuesto G5T2C5 fue de 37.6% y 49.5%, respectivamente.
El proceso de deposición se repitió utilizando ahora una solución de PEG y LiTFSI. En este caso, para calcular el contenido de PEG, dado que el LiTFSI presenta dos picos de degradación a 418 °C y 441 °C, se consideró la temperatura de degradación (Toffset) del polímero. Esta última corresponde al punto en el que termina la descomposición térmica del PEG, permitiendo su cuantificación dentro de la muestra. El análisis TGA reveló que tras dos deposiciones, la muestra G5T2C2 contenía 45% de PEG y 19.3% de LiTFSI, mientras que la muestra G5T2C5 contenía 43.3% y 18.2%, respectivamente. Así, se verifica que el aerogel con menor cantidad de arcilla es capaz de absorber más material activo, lo que puede explicarse por la mayor cantidad relativa de gelatina en la dicha muestra y por un efecto apantallador de la arcilla con respecto a la absorción.
Uno de los factores clave para aumentar la conductividad en electrolitos sólidos, como el sistema PEG-LiTFSI, es la reducción de la cristalinidad. Esto se debe a que la conducción en estado sólido se debe a la parte amorfa del polímero [6] La tabla 1 muestra los valores de cristalinidad, calculados por DSC después de borrar la historia térmica de la muestra y normalizando el valor real de PEG absorbido de acuerdo a los resultados de TGA. El PEG se caracteriza por una muy elevada cristalinidad, del 90.1% en este caso. Cuando el polímero se infiltró en las matrices porosas de los aerogeles, su cristalinidad disminuyó ligeramente, probablemente debido a la interrupción de la organización cristalina por interacciones con la matriz. En presencia de LiTFSI, se produjo una reducción adicional de la cristalinidad, debido tanto al efecto de la matriz como a la propia incorporación de la sal de litio [7] Los valores de cristalinidad obtenidos fueron de 79.1% y 37.1% para el aerogel G5T2C2, y de 85.7% y 20.4% para G5T2C5, con y sin sal de litio, respectivamente (Tabla 1).
Tabla 1. Cristalinidad (Xc) y porosidad de los aerogeles antes y después de dos infiltraciones con PEG-LiTFSI.
| Aerogel | Cristalinidad (%) | Porosidad (%) | ||
| PEG | PEG+LiFTSI | Sin infiltrar | PEG+LiFTSI | |
| G5T2C2 | 79,1 | 37,1 | 99,3 ± 0,4 | 72 ± 2 |
| G5T2C5 | 85,7 | 20,4 | 92,9 ± 0,1 | 76 ± 2 |
Los resultados de porosidad de los aerogeles calculada a partir de picnometría de He, antes y después de dos infiltraciones de PEG y LiTFSI se indican también en la tabla 1. La muestra G5T2C2 pura presenta una porosidad excepcionalmente alta, lo que explica la absorción posterior de una mayor cantidad de polímero. Tras las dos infiltraciones la porosidad cubierta fue del 27.3%, siendo la porosidad remanente del 72%, que podría incluso usarse para albergar un electrolito líquido. En el caso de la muestra G5T2C5, que inicialmente presenta menor porosidad, se verifica un cubrimiento menor, 16.9% de la porosidad, confirmando una menor absorción de PEG-LiTFSI
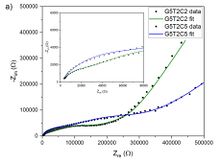
La espectroscopía de impedancia se empleó para estudiar la conductividad de las muestras. El sistema poroso puede considerarse de hecho como un electrolito sólido policristalino. Cuando este sistema se coloca entre electrodos bloqueantes, el circuito equivalente esperado muestra tres sistemas RC en paralelo, correspondientes a la fase cristalina, las fronteras cristalinas y la interfaz electrodo-electrolito.(figura 3)
Figura 3. Circuito equivalente empleado para ajustar los valores de a) G5T2C2 y b) G5T2C5.
Además, dado que el electrolito es sólido y altamente poroso, en lugar de un comportamiento puramente capacitivo a bajas frecuencias debido a la acumulación de carga en los electrodos, puede esperarse también una contribución relacionada con fenómenos de difusión [8]. Por ello, la parte difusiva se modeló con un elemento de impedancia de Warburg en el caso de G5T2C5, mientras que en la muestra G5T2C2, el segmento lineal presentó una pendiente significativamente mayor de 45°, por lo que no pudo ser ajustada con este elemento (figura 4a). En ese caso se utilizó un elemento de difusión anómala, evidenciando subdifusión debido a la reducción de la porosidad o a una estructura porosa compleja, probablemente por la combinación de: (i) una estructura porosa diferente, (ii) mayor cantidad de PEG absorbido y (iii) mayor cristalinidad del PEG en la muestra [9].
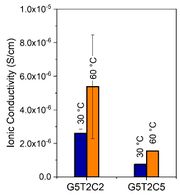
Figura 4 a) Gráfica de Nyquist de los dos aerogeles a 30 °C; b) gráficos de barras de la conductividad iónica de los dos aerogeles infiltrados a 30 °C y 60 °C.
Como era esperable, la conductividad iónica aumentó al doble al subir la temperatura de 30ºC a 60 °C, (figura 4b), por alcanzarse la de fusión del PEG. A pesar de la complejidad en el proceso de difusión, el compuesto G5T2C2, evidenció una mayor conductividad iónica volumétrica en comparación con la G5T2C5 que posee más cantidad de arcilla en la estructura. El valor máximo de conductividad alcanzado a temperatura ambiente fue de 3 x 10⁻⁶ S/cm.
4. Conclusiones
En este estudio se han sintetizado y analizado separadores conductivos utilizando aerogeles de gelatina activados con materiales iónicamente activos como PEG y LiTFSI. Los resultados indican que es al infiltrar el material activo se reduce la cristalinidad del polímero, lo que sugiere que las interacciones con la matriz porosa promueven la formación de mayor cantidad de fase amorfa. A pesar de mostrar un proceso de difusión complejo, la muestra G5T2C2 presentó mayor conductividad iónica en comparación con la muestra de mayor contenido de arcilla. Este hecho sugiere que un mayor contenido de polímero amorfo conductor incrementa positivamente el rendimiento del separador. El recubrimiento de parte de la porosidad de los aerogeles con materiales iónicamente activos, ha permitido obtener una conductividad intrínseca de 3 x 10⁻⁶ S/cm, manteniendo una alta porosidad remanente (72%). Este estudio representa un primer paso que, junto con futuras investigaciones sobre la estabilidad electroquímica y la interacción del separador con electrolitos líquidos, abre la puerta a separadores más eficientes y seguros para dispositivos electroquímicos como baterías y supercondensadores.
Agradecimientos.
Los autores agradecen la ayuda recibida por el proyecto EcoPolyRub PID2023-151338NB-I00 financiado por MCIU/ AEI / 10.13039/501100011033 / FEDER, UE. Igualmente agradecen la ayuda recibida de la Generalitat de Catalunya en la convocatoria 2021SGR01042. Serena Amenta agradece la financiación recibida por MUR – DM 352/2022 a través del proyecto PNRR-NGEU.
Referencias
[1] K. Zhou et al., “Single-Atom Zirconium Coordination Polyimide Aerogel as Separator Coating Toward High-Rate Lithium Metal Battery,” Adv Funct Mater, Jan. 2024, doi: 10.1002/adfm.202411963.
[2] R. Razaq et al., “Fe/Zr binary MOF-based separator for highly efficient polysulfide adsorption and conversion in Li-S batteries,” J Power Sources, vol. 624, Dec. 2024, doi: 10.1016/j.jpowsour.2024.235527.
[3] L. Raafat et al., “Shape-Conformable, Eco-Friendly Cellulose Aerogels as High-Performance Battery Separators,” ACS Appl Energy Mater, vol. 4, no. 1, pp. 763–774, Jan. 2021, doi: 10.1021/acsaem.0c02612.
[4] D. Lin et al., “A Silica-Aerogel-Reinforced Composite Polymer Electrolyte with High Ionic Conductivity and High Modulus,” Advanced Materials, vol. 30, no. 32, Aug. 2018, doi: 10.1002/adma.201802661.
[5] L. G. De la Cruz, T. Abt, N. León, and M. Sánchez-Soto, “Properties of Freeze-Dried Gelatin/Clay Aerogel Composites Crosslinked with Tannic Acid,” ACS Appl Polym Mater, vol. 5, no. 10, pp. 7774–7785, Oct. 2023, doi: 10.1021/acsapm.3c00971.
[6] Z. Li et al., “Ionic Conduction in Polymer-Based Solid Electrolytes,” Apr. 05, 2023, John Wiley and Sons Inc. doi: 10.1002/advs.202201718.
[7] F. Barroso-Bujans et al., “Intercalation and confinement of poly(ethylene oxide) in porous carbon nanoparticles with controlled morphologies,” Macromolecules, vol. 47, no. 24, pp. 8729–8737, Dec. 2014, doi: 10.1021/ma501607e.
[8] M. A. Careem, I. Syafiq, M. Noor, and A. K. Arof, “2 Impedance Spectroscopy in Polymer Electrolyte Characterization,” 2020.
[9] J. Bisquert and A. Compte, “Theory of the electrochemical impedance of anomalous diffusion,” 2001. [Online]. Available: www.elsevier.nl/locate/jelechem
Document information
Accepted on 30/06/25
Submitted on 10/04/25
Licence: Other