1 Introducción
Como es bien sabido, la impresión 3D está marcando un antes y un despues en el área de la ingeneiría del diseño y en la fabricación debido a que esta nueva tecnología permite abordar la fabricación de elementos muy diversos que por sus características es difícil de obtener mediante las técnicas clásicas de fabricación.
A diferencia de los métodos tradicionales, como puede ser el mecanizado, basado en la extracción de material (torneado, fresado, ...), la impresión 3D forma parte de lo que se conoce como procesos de fabricación aditiva [1]. Esta tecnología surge ante la necesidad de rapidez, adaptación, flexibilidad y bajos costes en los procesos de fabricación. Existen diversas tecnologías siendo la impresión por deposición fundida (FDM) unas de las más extendidas.
1.1 Modelado por Deposición Fundida
La impresión por FDM se basa en la fabricación tridimensional de un objeto a partir del depósito capa a capa de un material, generalmente un polímero, previamente fundido. Así, se parte de un material en forma de filamento que es succionado y fundido por el extrusor de la impresora y depositado capa a capa sobre una placa, formando la pieza deseada. Esta pieza es fabricada a partir de un modelo digital previamente diseñado (AutoCad, SolidWorks..).
Los materiales a emplear estarán condicionados por los requerimientos del propio método y por las características del producto a fabricar, en función de su aplicación final. Esta tecnología está presente en un amplio abanico de sectores, entre los que se encuentran la industria de la automoción, construcción, aeronáutica, alimentaria, téxtil, biomédica, entre otras muchas. En el caso particular de la ingeniería biomédica, la impresión 3D-FDM está siendo de gran ayuda tanto a la hora de personalizar dispositivos biomédicos como para abordar desarrollos que con otras técnicas sería imposible.
1.2 Impresión 3D en ingeniería biomedica
La ingeniería biomédica es una disciplina que aplica los principios y las técnicas de la ingeniería en el campo de la biomedicina, teniendo como objetivo el diseño y construcción de productos, herramientas y tecnologías de uso médico. Estos desarrollos implican dispositivos y equipamientos médicos, en las diversas áreas clínicas, tanto para el diagnóstico como el tratamiento de enfermedades.
En este campo tres son los ejes principales de actuación: (1) biomodelos para la preparación de intervenciones quirurgícas, (2) diseño y fabricación de dispositivos biomédicos personalizados (prótesis , implantes, ferulas, guías, etc.) y (3) andamios porosos para medicina regenerativa/ingeniería de tejidos.
A la hora de abordar cualquier desarrollo dentro de estas tres líneas estratégicas, dos son los elementos básicos que debemos tener presentes. En primer lugar si el dispositivo será empleado en el interior del cuerpo humano o en contacto con tejidos biológicos; en ese caso los materiales de partida y el propio dispositivo final deben cumplir con la especificación de biomaterial. El segundo aspecto corresponde a la necesidad de disponer de un conocimiento básico del tejido biológico que se pretende sustituir o regenerar.
1.3 Biomateriales
Los biomateriales son sustancias naturales o sintéticas cuya misión es actuar con sistemas biológicos con el fin de evaluar, tratar, aumentar o sustituir algún tejido, órgano o función del cuerpo [2]. Atendiendo a su estructura podemos clasificarlos en tres tipos: metales (destacan los aceros inoxidables, aleaciones cobalto-cromo, titanio tanto puro como aleación), polímeros (como el ácido poliláctico, nylon, PEEK), cerámicas (como la alúmina, zirconia, nitruro de silicio, fosfato calcio) y composites.
En el caso particular de la biocerámicas, uno de los principales exponentes es la hidroxiapatita (HA). Una cerámica formada por átomos de calcio, fósforo e hidrógeno siguiendo la fórmula Ca10(PO4)6(OH)2. En la HA natural se encuentran otros elementos como el sodio, cloro, carbonatos y magnesio, que aunque en cantidades reducidas, tienen un papel importante en la regeneración ósea. En el caso de las biocerámicas obtenidas de forma sintética, en su gran mayoría, están basadas en fosfatos cálcicos con diferentes estructuras cristalinas tanto de tipo apatíticas (destacando la hidroxiapatita) como no-apatíticas (principalmente β-tricalcio fosfato) [2,3-6].
Explorar el gran potencial de la biodiversidad marina, respetando la regeneración de la misma, para la obtención de nuevos biomateriales, es un campo de investigación de grande interés. Los recursos marinos nos ofrecen estructuras y composiciones diseñadas y optimizadas por la naturaleza durante millones de años. Dentro de esta área, la posibilidad de revalorizar los subproductos de la pesca para obtener productos de alto valor añadido, cobra un interés doble. Además de abordar un problema de salud, también se aborda la eficiencia cuando se utiliza una materia prima. Destacan las estrategias basadas en el aprovechamiento de las espinas de pescado [3,4] y de los dientes de tiburón [5,6].
Así, el objetivo general de este trabajo de investigación es el desarrollo de un nuevo filamento para impresión 3D basado en la combinación de PLA y una biocerámica de origen marino. Su ámbito de aplicación se encuentra en la fabricación de biomodelos, dispositivos biomédicos y andamios porosos tridimensionales.
2 Materiales y Métodos
2.1 Biomateriales
Los biomateriales de partida empleados para la fabricación del nuevo filamento son: (1) biocerámica de origen marino (desarrollada en el grupo de novos materiais de la UVIGO [5,6] ) y (2) ácido poliláctico (PLA) comercial. Como veremos más adelante estos materiales se combinaron en diferentes proporciones para estudiar el porcentaje de biocerámica que se puede incorporar en el filamento manteniendo la funcionalidad del mismo de cara a la impresión 3D.
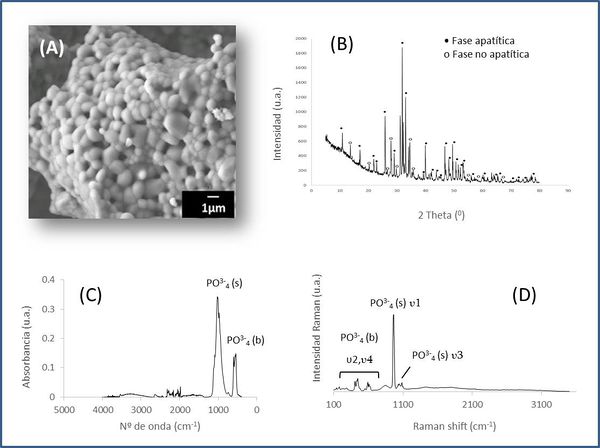
La biocerámica de origen marino, Biofast, es obtenida a partir de la revalorización de los dientes de tiburón de la especie Prionace Glauca. Este proceso consiste en tres fases básicas: (1) molienda, (2) tamizado y (3) pirolización [5,6]. En la Figura 1 se muestran resultados del análisis fisicoquímico de esta biocerámica. La micrografía de electrones secundarios (Figura 1-A) permite observar su estructura globular y porosa. En cuanto a su estructura cristalina, el patrón de difracción de rayos X (Figura 1-B) confirma que se trata de un material cristalino bifásico, formado por un 63% de fase apatítica (hidroxiapatita/fluorapatita) y un 37% de fase no apatítica (β-TCP /whitlockite) [5,6]. En cuanto a su estructura de enlaces analizada por espectroscopía IR y Raman (Figura 1-C y D) respectivamente, podemos comprobar la presencia de las bandas asociadas a los grupos fosfato (PO43-), en modo de tensión (s) 930–1100 cm-1 y de flexión (b) 400–600 cm-1, típicas de biocerámicas basadas en fosfatos cálcicos.
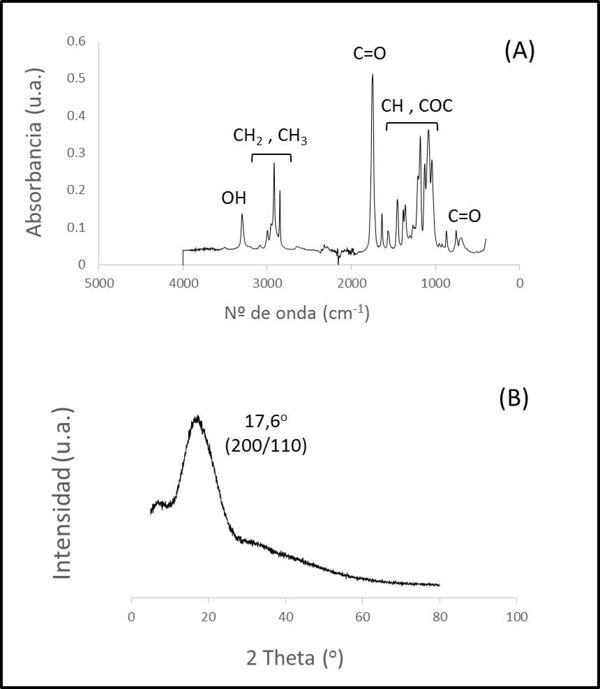
Como ya se indicó anteriormente, el polímero base de este nuevo filamento es el PLA. En este caso disponemos de un biomaterial comercial en forma de pellets, con un tamaño de 3 mm de diámetro aproximadamente. Necesitamos reducir el tamaño para obtener un granulado de unas dimensiones lo mas semejantes posibles a las de la biocerámica, para que así la mezcla sea homogénea. Este proceso consistió en: (1) congelar durante 20 minutos a -80ºC para fragilizar el polímero y así poder molerlo (2) moler y (3) tamizar. De la misma forma que en el caso de la biocerámica, y aunque los pellets de PLA son comerciales, también fue sometido a un proceso de caracterización previa antes de su utilización en la fabricación del nuevo filamento. En este caso se emplearon la espectroscopía infrarroja (Figura 2-A) y la difracción de rayos x (Figura 2-B).
En el espectro IR podemos identificar grupos funcionales característicos de este polímero y que según la literatura [7] corresponden a grupos C=O (1747 cm-1 y 756 cm-1) , CH2 y CH3 (2840 -2950 cm-1 ), COC (1000-1400 cm-1) y OH ( 2915 cm-1). El análisis por difracción de rayos X muestra un pico con un máximo alrededor de 17,6º típico del ácido poliláctico correspondiente a los planos (200) y (110) de la estructura ortorrómbica [7].
2.2 Extrusión e impresión 3D
La fabricación del filamento se realiza previa mezcla de los biomateriales de partida, utilizando una mezcladora Túrbula. Seguidamante, el proceso de extrusión se realizó en un equipo Filastruder de bajo coste. Varias formulaciones de filamento fueron obtenidas tras la extrusión de mezclas con proporciones variables PLA/Biofast.
El método de impresión 3D utilizado es el modelado por deposición fundida (FDM) con un equipo RepRap BCN3D+, tambien de bajo coste.Tanto la pantalla de la impresora como el programa de PC tienen un software muy intuitivo y sencillo de usar. Desde ellos se definen los parámetros a ajustar, como la temperatura a que deseamos calentar cada uno de los extrusores o la temperatura de la cama y cargamos las piezas diseñadas para imprimir.
Tanto los filamentos extruidos como las piezas impresas por FDM son caracterizados físicoquímicamente. La morfología superficial y composición cualitativa mediante microscopía electronica de barrido con sistema de análisis de rayos x (SEM/EDS) y estructura de enlaces a través de espectroscopía Infraroja (FTIR) y Raman (TF-RAMAN).
3 Resultados y Discusión
3.1 Caracterización físicoquímica
En la Tabla 1 se muestran las diferentes proporciones PLA/Biofast utilizadas para la fabricación de los filamentos. No se excedió el 40% de proporción de biocerámica incorporada ya que a este nivel se detectaba una elevada fragilidad del filamento producido.
| Muestra | PLA (%) | Biofast(%) |
| FIL0 | 100 | 0 |
| FIL2 | 98 | 2 |
| FIL3 | 97 | 3 |
| FIL5 | 95 | 5 |
| FIL10 | 90 | 10 |
| FIL20 | 80 | 20 |
| FIL40 | 60 | 40 |
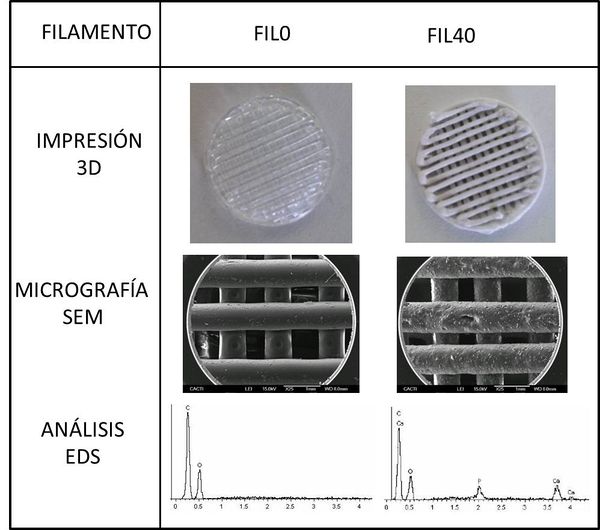
En la Figura 3 se muestra una micrografía SEM por electrones retrodispersados para una sección del filamento FIL40. En ella podemos observar las partículas biocerámicas uniformemente repartidas en la matriz del polímero.
En la Figura 4 se presentan, a modo de ejemplo, las imágenes ópticas, micrografías SEM y análisis EDS para los andamiajes porosos fabricados con las composiciones extremas de la serie. Como podemos observar la incorporación de la biocerámica origina una modificación del acabado del andamio, presentando una morfología superficial más rugosa. La presencia de la biocerámica también queda evidenciada en los análisis EDS al detectar claramente la señal de Ca y P en el andamio producido con el hilo FIL40.
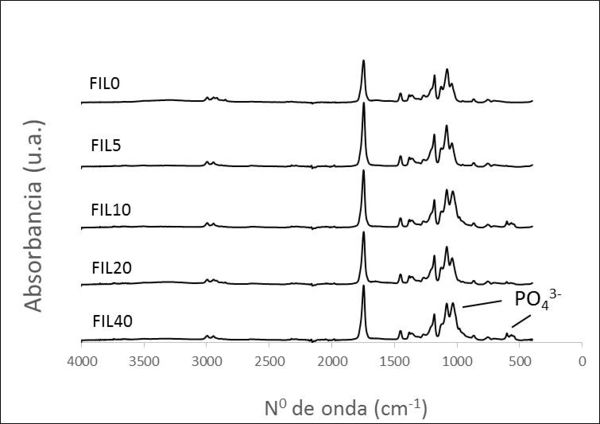
En cuanto al análisis de la estructura de enlaces mediante la espectroscopía FTIR (Figura 5) se comprueba la presencia de las bandas de absorción típicas del polímero PLA. A medida que incorporamos biocerámica a la mezcla se detectan nuevas bandas asociadas a los enlaces PO43-, típicos de biocerámicas de base fosfato cálcico; en particular el modo de estiramiento alrededor de 1060 cm-1 y un doblete en la zona de 500-600 cm-1 correspondiente al modo de flexión, como ya se detectaban en el espectro de la biocerámica de partida (Figura 1).
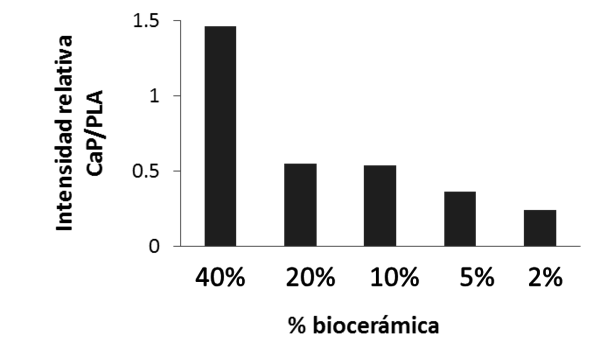
La caracterización mediante espectroscopía Raman vuelve a corroborar este resultado, pudiéndose identificar las bandas características del PLA. A medida que incorporamos más porcentaje de biocerámica a la mezcla más se detecta la presencia de las correspondientes a los grupos PO43-. A partir de estos espectros se realizó un análisis cuantitativo de la intensidad para dos bandas Raman (970 cm-1 y 862 cm-1) con el objeto de calcular la razón I Biofast 970 cm-1 / IPLA 862 cm-1. Los resultados se muestran en la Figura 6 y como podemos observar esta ratio aumenta a medida que el porcentaje de biocerámica incorporado en el filamento se incrementa.
3.2 Prueba concepto
Finalmente se realizó una primera prueba concepto con una de las formulaciones de este nuevo filamento. En este caso la aplicación es en el ámbito veterinario, en partlcular una cuña (Figura 7) para la patología clínica de rotura ligamento cruzado anterior en rodilla canina. El objetivo es estabilizar la articulación. Los parámetros utilizados fueron:
- Impresora FDM: RepRap BCN3D+
- Filamento PLA comercial de 3 mm de diámetro
- Filamento PLA + 3% Biofast de 3 mm de diámetro
- Boquilla de 0,4 mm de diámetro
- Temperatura de 215 ºC
4 Conclusiones
El presente estudio confirma la viabilidad para la fabricación de un nuevo filamento en base a PLA & Biofast (biocerámica de origen marino) y su utilización para impresión 3D-FDM. Los análisis demuestran que las partículas biocerámicas se encuentran distribuidas uniformemente en la matriz del polímero y su incorporación puede ser controlada en función de la mezcla seleccionada. En cuanto a la estructura cristalina y de enlaces, los procesos de fabricación no originan modificaciones que puedan afectar la biocompatibilidad del dispositivo final. Así, estos nuevos filamentos se muestran como potenciales candidatos para su aplicación en ingeniería biomédica.
Agradecimientos
Esta investigación fue parcialmente financiada por el programa INTERREG V España-Portugal_POCTEP (0245 IBEROS1E y 0302 CVMARI1P) y la Xunta de Galicia (GRC-ED431C 2017_51 y ED431D 2017/13). Los autores agradecen al CACTI de la Universidad de Vigo su colaboración.
Referencias
[() ] M. Puerto Pérez-Pérez, Emilio Gómez, Miguel A. Sebastián, ed. MDPI, 2018. Additive Manufacturing in 2030: Implications for Education and Employment in Spain (2018).
2] Williams D.F. The Williams Dictionary of Biomaterials. Liverpool, UK: University Press pág.40 (1999).
[3] M. Boutinguiza, F. Lusquiños, R. Comesaña, A. Riveiro, F. Quintero, J. Pou. Production of microscale particles from fish bone by gas flow assisted laser ablation. Applied Surface Science, 254: 1267 (2007).
[4] M. Boutinguiza, J. Pou, R. Comesaña, F. Lusquiños, A. de Carlos, B. Leon. Biological hydroxyapatite obtained from fish bones. Materials Sciences and Engineering C, 32: 478–486 (2012).
[5] M. López-Álvarez, E. Vigo, C. Rodríguez-Valencia, V. Outeiriño-Iglesias, P. González, J. Serra. In vivo evaluation of shark teeth-derived bioapatites. Clin. Oral Impl. Res. 28, e91–e100 (2017).
[6] M. López-Álvarez, S. Pérez-Davila, C. Rodríguez-Valencia, P. González, J. Serra. The improved biological response of shark tooth bioapatites in a comparative in vitro study with synthetic and bovine bone grafts. Biomed. Mater. 11, 035011 (2016).
[7] E. A. Segura González. Diseño, caracterización y comportamiento en servicio de materiales basados en Ácido Poliláctico (PLA) con potencial utilidad en el empaquetado de alimentos. Tesis Doctoral pág. 3-16 (2016).
Document information
Published on 08/05/22
Accepted on 08/05/22
Submitted on 08/05/22
Volume 03 - Comunicaciones Matcomp17 (2019), Issue Núm. 4 - País invitado: Colombia. Materiales Multifuncionales. Reciclaje y Sostenibilidad, 2022
DOI: 10.23967/r.matcomp.2022.05.012
Licence: Other
Share this document
Keywords
claim authorship
Are you one of the authors of this document?