Resumo
Introdução
O impacto do uso de ácido acetilsalicílico (AAS), metformina e estatinas no cancro próstata pode ter grande importância, mas este ainda não é claro dado que estudos anteriores mostraram resultados controversos. Este estudo pretende avaliar a possível associação do consumo de AAS, metformina e estatinas com as características patológicas e o risco de recidiva bioquímica (RB) das neoplasias prostáticas.
Materiais e métodos
Analisaram‐se 311 doentes submetidos a prostatectomia radical (PR) no Hospital de Braga entre janeiro de 2010 e junho de 2014. Os dados foram obtidos através dos registos clínicos e foi calculada a associação bruta e ajustada entre o uso de cada fármaco e o antigénio específico da próstata (PSA), estadio patológico, score de Gleason, presença de margens cirúrgicas positivas e risco de recidiva bioquímica.
Resultados
Dos 311 pacientes, 26 (8,4%) estavam medicados com AAS, 35 (11,3%) com metformina e 112 (36%) com estatinas. Os indivíduos medicados com AAS apresentaram um valor de PSA inferior comparativamente com os não medicados (5,9 vs. 8,9 ng/m; p = 0,008). O seu uso foi um preditor independente de margens cirúrgicas positivas (OR = 3,77; IC 95%: 1,45‐9,78). O uso de metformina estava associado a estádios patológicos mais avançados, nomeadamente pT3b (20 vs. 7,7%; p = 0,048). Não foram detetadas outras associações entre o cancro da próstata e a utilização de AAS, metformina ou estatinas.
Conclusão
O uso de AAS, metformina e estatinas não tem efeito benéfico claro sobre o cancro da próstata, observando‐se, pelo contrário, neste estudo uma associação entre o uso de metformina e estádios patológicos mais avançados. Estes resultados deverão ser validados noutros estudos com amostras maiores e com maior tempo de seguimento. Confirma‐se a associação já detetada noutros estudo que os doentes com cancro da próstata a tomar AAS têm PSA mais baixos, cujo mecanismo deverá ser esclarecido futuramente.
Abstract
Background
The impact of using ASA (acetylsalicylic acid), metformin and statins on the prostate cancer may be significant, but is not clear and findings from previous studies are inconsistent. This study aims to evaluate the relationship between the use of ASA, metformin and statins and the pathological characteristics and risk of biochemical recurrence (BCR) of prostate cancer.
Methods
A total of 311 patients submitted to radical prostatectomy (RP) at Hospital de Braga between January 2010 and June 2014 were analyzed. Data were obtained from clinical records and the crude and adjusted association between the use of a specific drug and prostate specific antigen (PSA), pathological stage, Gleason score, positive surgical margin and risk of biochemical recurrence were calculated.
Findings
Overall, 26 (8.4%) of the patients used ASA, 35 (11.3%) metformin and 112 (36%) statins. The ASA users had a lower PSA compared with the non users (5.9 vs. 8.9 ng/m; p = 0.008). Its use was an independent predictor of positive surgical margin (OR = 3.77; IC 95%: 1.45‐9.78). The use of metformin was associated with advanced pathological stages, more precisely pT3b (20% vs. 7.7%; p = 0.048). No other differences were detected between ASA, metformin and statins users.
Conclusions
The use of ASA, metformin and statins has no beneficial effect on prostatic cancer patients. On the opposite, an association between the use of metformin and advanced pathological stages was observed. These results should be validated in other larger samples and longer follow‐up. The association between the use of ASA and lower PSA was already detected in other studies, whose mechanism should be clarified in future
Palavras‐chave
Cancro da próstata ; Ácido acetilsalicílico ; Metformina ; Estatinas ; Recidiva bioquímica
Keywords
Prostate cancer ; Acetylsalicylic acid ; Metformin ; Statins ; Biochemical recurrence
Introdução
O cancro da próstata constitui atualmente o cancro não cutâneo mais frequente nos indivíduos do sexo masculino no norte da América e na Europa1 ; 2 . É também, no mundo ocidental, a segunda maior causa de morte por cancro nos homens depois do cancro do pulmão1 ; 2 .
A prostatectomia radical (PR) é uma das abordagens terapêuticas mais utilizada em doentes com cancro da próstata localizado3 , contudo, quase 40% dos pacientes intervencionados apresentam recidiva bioquímica (RB)4 . Este atual problema de saúde pública apresenta como fatores de risco não modificáveis bem estabelecidos a idade avançada, a raça negra e a história familiar5 ; 6 .
No intuito de estabelecer possíveis estratégias de prevenção primária ou secundárias têm sido estudados outros fatores de risco e prognóstico. A exposição a hormonas endógenas, a ingestão de gorduras, a obesidade, os hábitos tabágicos e alcoólicos, a exposição ocupacional e a atividade física são exemplos de fatores investigados, mas com resultados ainda inconclusivos7 . Existe evidência da redução da incidência do cancro da próstata em indivíduos medicados com inibidores da 5‐α‐redutase, mas este efeito está associado a um discutível aumento da incidência dos tumores histologicamente mais agressivos8 . Para além destes, nos últimos anos foram desenvolvidos vários estudos que avaliam os efeitos da administração de determinados fármacos, nomeadamente do ácido acetilsalicílico (AAS), metformina e estatinas, na supressão e proliferação das células tumorais.
O AAS é um anti‐inflamatório não esteroide (AINE), comumente prescrito em indivíduos com idade avançada como prevenção primária ou secundária de doenças cardiovasculares9 . A inibição da ciclocoxigenase‐2 (COX‐2) pelo AAS tem sido investigada como um mecanismo antitumoral. O seu efeito antiplaquetário em baixas doses parece impedir a invasão dos tecidos pelas células tumorais10 , assim como a neovascularização e a formação de metástases11 . O AAS mostrou ter efeitos protetores em relação ao cancro colorretal, outras neoplasias digestivas e cancro da mama12 . Além disso, uma meta‐análise concluiu existir uma associação inversa entre o uso de AAS e a incidência de cancro prostático13 . Além disso, já foi descrita uma redução da mortalidade do cancro da próstata com o uso de AAS em doentes com doença localizada14 , mas existem resultados contraditórios15 .
A diabetes mellitus (DM) tipo II é também uma doença comum e alguns estudos mostraram que está associada a cancro da próstata mais agressivo16 ; 17 . A metformina é um antidiabético oral frequentemente usado, existindo evidência de uma ação direta sobre as células tumorais, através da inibição da migração tumoral, da promoção da apoptose e a ativação da via da proteína cinase ativada por adenosina monofosfato18 . Está demonstrado que o uso de metformina tem efeitos benéficos na sobrevivência de vários tipos de cancro em doentes diabéticos e não diabéticos19 . Acrescente‐se que um estudo com doentes com DM tipo II revelou que o uso de metformina estava significativamente associado a uma menor incidência de cancro da próstata20 . Foi também reportada a associação do uso deste fármaco com uma diminuição do risco de RB, metastização e mortalidade por cancro da próstata21 ; 22 . No entanto, outros estudos não suportam estes achados18 ; 23 ; 24 ; 25 ; 26 .
As estatinas são fármacos inibidores da coenzima A 3‐hidroxi‐3‐metil‐glutaril redutase, sendo amplamente utilizadas para melhorar o perfil lipídico e diminuir a incidência e mortalidade de doenças cardiovasculares27 . Atualmente existe evidência de que as estatinas podem ter efeitos antitumorais em vários cancros, nomeadamente no da próstata, através da indução da apoptose e inibição do crescimento celular, angiogénese e invasão/metastização28 . Neste contexto, foram reportadas associações entre a administração de estatinas e a redução da incidência do cancro da próstata e da probabilidade de desenvolver doença agressiva ou fatal28 ; 29 ; 30 ; 31 ; 32 ; 33 ; 34 . Embora tenha sido reportado que a mortalidade específica por cancro da próstata é menor nos indivíduos medicados com estatinas, apresentando também estádios mais favoráveis29 , outros estudos não suportam estes resultados35 ; 36 ; 37 . Outro tema controverso é se o uso deste fármaco está associado a um risco menor de RB após a cirurgia, assim como a estádios menos avançados, já que existem estudos publicados com resultados contraditórios38 ; 39 .
Face aos resultados divergentes dos estudos anteriores e uma vez que os efeitos do uso destes fármacos sobre o cancro próstata ainda não são claros, este estudo pretende avaliar a possível associação do uso de AAS, metformina e estatinas com as características clínicas e patológicas das neoplasias da próstata dos indivíduos submetidos a PR. Além disso, pretende‐se ainda analisar a influência do uso destes fármacos sobre o risco de RB.
Métodos
Foram analisados de forma retrospetiva todos os doentes submetidos a PR no Hospital de Braga (HB) entre janeiro de 2010 e junho de 2014. Foi definido como critério de exclusão a ausência de registo informático sobre a medicação realizada.
A recolha de dados foi realizada através do sistema informático do HB (Glintt® ), procedendo à consulta dos processos clínicos eletrónicos dos utentes incluídos no estudo. Foi recolhida informação clínica pré‐operatória, nomeadamente idade dos pacientes aquando da PR, valor sérico do antigénio específico da próstata (PSA) pré‐operatório, realização de terapêutica crónica com AAS, metformina, estatinas, antecedentes pessoais de DM, dislipidemia e obesidade (através do índice de massa corporal calculado na consulta pré‐anestésica). O valor do PSA pré‐operatório em doentes medicados com inibidores da 5‐α‐redutase foi ajustado através da sua duplicação. Quanto ao uso dos fármacos referidos, não foi recolhida informação sobre doses ou duração do tratamento, já que estes dados eram muito escassos. Foi também consultado o resultado anátomo‐patológico da peça cirúrgica de PR, da qual se obteve o score de Gleason , estádio patológico (T), margens cirúrgicas e envolvimento de gânglios linfáticos. O acompanhamento dos doentes foi realizado com consultas trimestrais no primeiro ano e semestrais posteriormente. A avaliação analítica do PSA foi realizada em todas as consultas. A RB foi definida como 2 concentrações consecutivas de PSA igual ou superior a 0,2 ng/ml, tendo‐se registado o período de tempo (em meses) decorrido até à data da primeira medição.
A associação entre o uso dos fármacos e as variáveis quantitativas (PSA e idade) foi avaliada através da aplicação do teste de t‐student . O teste qui‐quadrado (χ2) foi aplicado para a associação entre as variáveis qualitativas.
Também foi realizada uma análise multivariada por regressão logística binária, ajustada às potenciais variáveis de confundimento: idade dos doentes, uso dos diferentes fármacos em estudo, DM, dislipidemia e PSA pré‐operatório.
Através do método Kaplan‐Meier, foram obtidas curvas de sobrevivência para estimar a probabilidade de sobrevivência livre de RB nos doentes medicados com os fármacos em estudo versus não medicados, aplicando‐se o teste de Logrank para comparação entre os 2 grupos e a regressão de Cox.
A base de dados e a análise estatística foram realizadas com recurso ao IBM Statistical Package for Social Science® (IBM SPSS versão 22.0). Foi considerado como nível de significância estatística p < 0,05 e um intervalo de confiança (IC) de 95%.
Este estudo foi aprovado pela Subcomissão de Ética para as Ciências da Vida e da Saúde da Universidade do Minho e pela Comissão de Ética do HB após apreciação do Protocolo de Investigação apresentado.
Resultados
Foram submetidos a PR 315 doentes, sendo que foram excluídos 4 por ausência de informação sobre a medicação no registo eletrónico. Assim, na amostra final foram incluídos 311 doentes, cujas características estão resumidas na tabela 1 . No total, 26 (8,4%) pacientes estavam medicados com AAS, 35 (11,3%) com metformina e 112 (36%) com estatinas. No global, 177 doentes não estavam a ser medicados com nenhum dos fármacos em estudo, 100 estavam a ser tratados com um dos medicamentos, 29 com 2 e apenas 5 doentes estavam medicados com os 3 fármacos. A idade média aquando da PR foi de 63,4 anos (DP = 6,4) e a média do PSA sérico foi de 8,6 ng/mL (DP = 5,9). Cerca de 53,4% apresentavam uma score de Gleason de 7 e 17,7% um score ≥ 8. Quanto ao estádio patológico, 18,5% apresentavam extensão extracapsular (T3a) e 9,1% invasão das vesículas seminais (T3b). Apenas 4,5% dos pacientes apresentavam invasão de gânglios linfáticos regionais. Após um seguimento médio de 19,8 meses (DP = 15,8), foi observado que 27 (8,7%) indivíduos apresentaram RB. Destes doentes, foi diagnosticado um caso de metastização à distância aos 36 meses de vigilância e 4 morreram.
| n | % | |
|---|---|---|
| Uso de AAS | 26 | 8,4 |
| Uso de metformina | 35 | 11,3 |
| Uso de estatinas | 112 | 36 |
| Diabetes mellitus | 49 | 15,8 |
| Dislipidemia | 118 | 37,9 |
| IMC ≥ 25 e ≤ 30 ≥ 30 | 53 21 | 49,5 19,6 |
| Score de Gleason ≤ 6 7 ≥ 8 | 90 166 55 | 28,9 53,4 17,7 |
| Estádio patológico (pT)'T2'T3a'T3b | 233 57 28 | 72,4 18,5 9,1 |
| Invasão de gânglios linfáticos | 14 | 4,5 |
| Margens cirúrgicas positivas | 143 | 46,1 |
| Recidiva bioquímica | 27 | 8,7 |
AAS: ácido acetilsalicílico; IMC: índice de massa corporal.
A tabela 2 sumariza as características clínicas e patológicas da amostra em estudo segregadas em 2 grupos para cada tipo de medicação (medicados versus não medicados). Relativamente à idade, observou‐se que os indivíduos medicados com os fármacos em estudo são cerca de 2 anos mais velhos comparativamente com os não medicados, embora esta diferença seja apenas estatisticamente significativa para as estatinas (p = 0,005). Os indivíduos medicados com AAS apresentaram um valor médio de PSA de 5,9 ng/mL, significativamente inferior comparativamente com os não medicados, que apresentaram um PSA médio de 8,9 ng/mL (p = 0,008). Quanto às características patológicas, nomeadamente o score de Gleason , a invasão de gânglios linfáticos regionais e as margens cirúrgicas, não se verificam diferenças estatisticamente significativas, com exceção da associação entre o uso de metformina e o estádio patológico mais avançado, nomeadamente pT3b, que correspondeu ao estádio apresentado em 20% dos pacientes medicados e em 7,7% dos não medicados (p = 0,042; resíduo ajustado padronizado = 2,1).
| Características | AAS | Metformina | Estatinas | |||
|---|---|---|---|---|---|---|
| Usa | Não usa | Usa | Não usa | Usa | Não usa | |
| N.° de doentes (%) | 26 (8,4) | 285 (91,6) | 35 (11,3) | 276 (88,7) | 112 (36) | 199 (64) |
| Idade média (DP) | 65,3 (6) | 63,2 (6,5) | 65,3 (5,6) | 63,1 (6,5) | 64,7 (5,5) | 62,6 (6,8) |
| p | 0,114 | 0,056 | 0,005 | |||
| PSA médio (DP) (ng/ml) | 5,9 (2,3) | 8,9 (6,1) | 9,6 (10) | 8,5 (5,3) | 8 (4,5) | 9 (6,6) |
| p | 0,008 | 0,911 | 0,198 | |||
| Score de Gleason n (%) ≤ 6 7 ≥ 8 | 12 (46,2) 11 (42,3) 3 (11,5) | 78 (27,4) 155 (54,4) 52 (18,2) | 12 (34,3) 14 (40) 9 (25,7) | 78 (28,3) 152 (55,1) 46 (16,7) | 33 (29,5) 57 (50,9) 22 (19,6) | 57 (28,6) 109 (54,8) 33 (16,6) |
| p | 0,125 | 0,207 | 0,741 | |||
| Estádio patológico n (%) T2 T3a T3b | 21 (80,8) 4 (15,4) 1 (3,8) | 202 (71,6) 53 (18,8) 27 (9,6) | 24 (68,6) 4 (11,4) 7 (20) | 199 (72,9) 53 (19,4) 21 (7,7) | 83 (74,8) 23 (20,7) 5 (4,5) | 140 (71,1) 34 (17,3) 23 (11,7) |
| P | 0,701 | 0,048 | 0,100 | |||
| Invasão de gânglios linfáticos n (%) | 2 (7,7) | 12 (4,2) | 2 (5,7) | 12 (4,3) | 7 (6,3) | 7 (3,5) |
| p | 0,330 | 0,663 | 0,265 | |||
| Margens cirúrgicas positivas n (%) | 15 (57,7) | 128 (45,1) | 14 (40) | 129 (46,9) | 43 (38,7) | 100 (50,3) |
| p | 0,217 | 0,44 | 0,051 | |||
AAS: ácido acetilsalicílico; DP: desvio padrão; PSA: antigénio específico da próstata.
Os resultados da regressão logística que avaliam a associação entre o uso dos fármacos em estudo e o estádio patológico estão representados na tabela 3 . Como se pode verificar, não foi encontrada associação independente entre uso dos fármacos e estádio patológico. Contudo, foi detetada uma associação significativa entre valores elevados de PSA pré‐operatório e o estádio patológico não limitado à próstata (T3) (OR = 1,12; IC 95%: 1,063‐1,18). Observou‐se também a associação independente entre o uso de AAS e margens cirúrgicas positivas (OR = 3,77; IC 95%: 1,45‐9,78).
| OR | IC 95% | p | |
|---|---|---|---|
| Estádio patológico T3a‐T3b | |||
| Uso de AAS | 0,89 | 0,30‐2,63 | 0,828 |
| Uso de metformina | 0,78 | 0,19‐3,26 | 0,73 |
| Uso de estatinas | 1,59 | 0,57‐4,45 | 0,38 |
| Margens cirúrgicas positivas | |||
| Uso de AAS | 3,77 | 1,45‐9,78 | 0,006 |
| Uso de metformina | 1,01 | 0,26‐3,97 | 0,989 |
| Uso de estatinas | 1,07 | 0,43‐2,72 | 0,879 |
AAS: ácido acetilsalicílico; OR: odds ratio; 95% IC: intervalo de confiança de 95%.
*1 Ajustada para idade, uso de outros fármacos em estudo, DM, dislipidemia e PSA pré‐operatório.
*2 Ajustada para idade, uso de outros fármacos em estudo, DM, dislipidemia, PSA pré‐operatório, estádio patológico e score de Gleason.
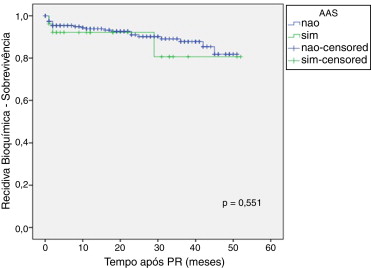
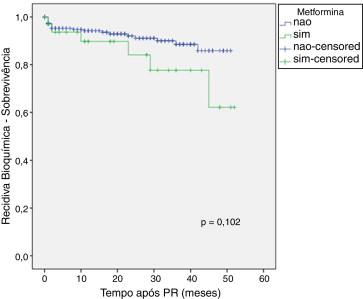
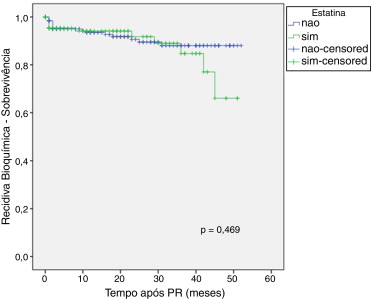
As Figura 1 , Figura 2 ; Figura 3 ilustram a sobrevida livre de RB nos doentes medicados com os fármacos em estudo versus não medicados. Globalmente, não foram detetadas diferenças significativas entre os grupos, embora seja aparente uma tendência para os utilizadores de metformina terem maior risco de RB. Quando estes dados foram analisados por regressão de Cox também não foram detetadas diferenças consoante o uso de fármacos em estudo (tabela 4 ).
|
|
|
Figura 1. Curva de sobrevivência de Kaplan‐Meier de acordo com o uso de ácido acetilsalicílico. |
|
|
|
Figura 2. Curva de sobrevivência de Kaplan‐Meier de acordo com o uso de metformina. |
|
|
|
Figura 3. Curva de sobrevivência de Kaplan‐Meier de acordo com o uso de estatinas p = 0,469. |
| HR | IC 95% | p | |
|---|---|---|---|
| Uso de AAS | 1,27 | 0,32‐5,11 | 0,738 |
| Uso de metformina | 2,50 | 0,38‐16,27 | 0,339 |
| Uso de estatinas | 3,03 | 0,57‐16,08 | 0,194 |
| Score de Gleason = 7 | 1,43 | 0,37‐5,49 | 0,607 |
| Score de Gleason ≥ 8 | 5,20 | 1,29‐20,96 | 0,021 |
| Estádio patológico pT3 | 1,50 | 0,60‐3,78 | 0,386 |
| Invasão de gânglios linfáticos | 3,72 | 0,96‐14,44 | 0,057 |
| Margens cirúrgicas positivas | 2,15 | 0,82‐5,64 | 0,119 |
AAS: ácido acetilsalicílico; HR: hazard ratio; 95% IC: intervalo de confiança de 95%.
- Ajustada para a idade, uso de outros fármacos em estudo, DM, dislipidemia, PSA pré‐operatório, score de Gleason , estádio patológico, invasão de gânglios linfáticos e margens cirúrgicas positivas.
O único preditor independente de RB foi ter score de Gleason ≥ 8, (HR = 5,2; IC 95%: 1,29‐20,96). Observou‐se ainda uma associação relevante, mas marginalmente não significativa entre a invasão de gânglios linfáticos regionais e o risco de RB (HR = 3,72; IC 95%: 0,96‐14,44).
Discussão
Neste estudo, os pacientes medicados com AAS apresentaram valores de PSA inferiores quando comparados com os não medicados. Verificou‐se que o uso de metformina está associado a maior probabilidade de doença avançada, nomeadamente o estádio patológico T3b. O score de Gleason ≥ 8 foi o único preditor independente do risco de RB. O uso de AAS foi associado, de forma independente, ao resultado de margens cirúrgicas positivas na análise patológica da peça cirúrgica.
Relativamente à associação entre o uso de AAS e valores inferiores de PSA sérico, os resultados são concordantes com estudos prévios14 ; 40 ; 41 ; 42 ; 43 ; 44 . O mecanismo exato pelo qual isto acontece não é claro. Sabe‐se que a inibição da COX‐2 pelo AAS resulta na diminuição da síntese prostaglandinas e da resposta inflamatória, com consequente diminuição do infiltrado inflamatório no epitélio glandular, o que pode ser suficiente para explicar a redução das concentrações séricas de PSA. Especula‐se também que pode ser secundária à redução do fluxo sanguíneo para o tecido prostático, limitando a capacidade deste para secretar PSA para a circulação45 . Os restantes resultados negativos relativos à AAS estão também de acordo com os estudos de Choe et al. e Flahavan et al. uma vez que estes não reportaram associação entre o uso do AAS e estádio patológico e o score de Gleason14 ; 46 . A associação independente detetada entre o uso deste fármaco e as margens cirúrgicas positivas não é clara, não tendo sido encontrada uma explicação plausível para este resultado.
Foi observado que uso de metformina estava significativamente associado ao estádio patológico. Este resultado não se encontra replicado na literatura médica, podendo ser justificado pelo facto dos doentes medicados com este fármaco apresentarem DM (apenas um doente medicado com metformina não era diabético), que está relacionada com casos de cancro prostático avançado47 ; 48 ; 49 . Contrariamente aos nossos resultados, um estudo reportou que a metformina estava associada a estádios de cancro prostático menos avançados e a uma diminuição do risco de RB21 . Outros estudos anteriores não revelaram qualquer associação com as características patológicas ou o risco de RB23 ; 25 ; 26 ; 50 .
Os nossos resultados sugerem que o uso de estatinas não tem efeito significativo sobre as características patológicas ou clínicas do cancro da próstata, nem sobre o risco de RB, o que está de acordo com estudos recentes sobre a associação com o estádio patológico51 ; 52 e com uma meta‐análise de 17 estudos53 que avaliou o risco de RB. Contrariamente, outros estudos detetaram uma associação inversa entre o seu uso e a probabilidade de desenvolver cancros prostáticos com estádios avançados54 ; 55 , bem como uma diminuição dos valores de PSA pré‐operatório56 ; 57 .
O risco de RB foi associado ao score de Gleason ≥ 8, constituindo um preditor independente consistente de RB, o que foi concordante um estudo prévio58 .
Este estudo tem limitações, nomeadamente por ser retrospetivo, limitando a investigação à informação recolhida por rotina o que impossibilitou a análise das doses e duração das terapêuticas em estudo. A amostra também é limitada, sendo que apenas 26 homens estavam medicados com AAS e 35 com metformina. Adicionalmente, a mediana do tempo de seguimento dos doentes foi de apenas 18 meses, tendo sido acompanhados no máximo por um período até 54 meses, o que é insuficiente para avaliar corretamente o efeito na RB e tornou impossível avaliar a associação com a metastização e mortalidade.
Em relação à associação dos fármacos em estudo com as características patológicas e PSA pré‐operatório, é importante considerar o potencial viés de diagnóstico que todos os estudos sobre este tópico apresentam, uma vez que os pacientes medicados com este tipo de fármacos apresentam um maior acompanhamento médico (por apresentarem mais comorbilidades e por causalidade reversa de estarem mais medicados), o que pode influenciar a fase em que a neoplasia é diagnosticada.
Contudo, este é o primeiro estudo que analisa em conjunto o uso de AAS, metformina e estatinas, tentando descortinar de forma integrada o potencial efeito protetor sobre a agressividade do cancro da próstata e risco de RB. Isto é vantajoso, dado que muitos doentes estão medicados com 2 ou 3 dos fármacos em conjunto, permitindo desta forma ajustar o efeito de cada uma das substâncias ao uso das outras. Além disso, a análise foi ainda ajustada para comorbilidades como a DM e dislipidemia, que também poderiam ter influência sobre a progressão do cancro prostático.
Conclusões
O uso de AAS está associado a valores de PSA pré‐operatório significativamente mais baixos, e, de forma independente, a margens cirúrgicas positivas. Contudo, o mecanismo fisiopatológico subjacente não é claro. O uso de AAS, estatinas ou metformina não têm efeito significativo sobre as restantes características patológicas do cancro prostático ou sobre o risco de RB, com exceção da metformina no estádio patológico mais avançado, não sendo, contudo, claro se é por efeito causal ou confundimento pela DM.
Responsabilidades éticas
Proteção de pessoas e animais
Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados
Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escrito
Os autores declaram que não aparecem dados de pacientes neste artigo.
Bibliografia
- 1 Cancer Research UK. Prostate Cancer–Cancer Statistics Key Facts [Internet]. 2013 [citado 26 Mar 2014]. Disponível em: http://www.cancerresearchuk.
- 2 American Cancer Society. Cancer Facts & Figures Prostate Cancer 2014. Atlanta: GA; 2014.
- 3 A. Heidenreich, J. Bellmunt, M. Bolla, S. Joniau, M. Mason, V. Matveev, et al.; EAU guidelines on prostate cancer. Part 1: Screening, diagnosis, and treatment of clinically localised disease; Eur Urol., 59 (2011), pp. 61–71
- 4 S.A. Boorjian, J.A. Eastham, M. Graefen, B. Guillonneau, R.J. Karnes, J.W. Moul, et al.; A critical analysis of the long‐term impact of radical prostatectomy on cancer control and function outcomes; Eur Urol., 61 (2012), pp. 664–675
- 5 O.W. Brawley; Prostate cancer epidemiology in the United States; World J Urol., 30 (2012), pp. 195–200
- 6 E.D. Crawford; Understanding the epidemiology, natural history, and key pathways involved in prostate cancer; Urology., 73 (2009), pp. S4–S10
- 7 A.W. Hsing; Hormones and prostate cancer whats next?; Epidemiol Rev., 23 (1) (2001), pp. 42–58
- 8 T.J. Wilt, R. Macdonald, K. Hagerty, P. Schellhammer, J. Tacklind, M.R. Somerfield, et al.; 5‐α‐Reductase inhibitors for prostate cancer chemoprevention: An updated Cochrane systematic review; BJU Int., 106 (10) (2010), pp. 1444–1451
- 9 Centre H and SCI. Prescriptions dispenser in ther community, Engaland 2003‐13. 2014.
- 10 P.C. Elwood, A.M. Gallagher, G.G. Duthie, L.A. Mur, G. Morgan; Aspirin, salicylates, and cancer; Lancet., 373 (2009), pp. 1301–1309
- 11 N.M. Bambace, C.E. Holmes; The platelet contribution to cancer progression; J Thromb Haemost., 9 (2011), pp. 237–249
- 12 C. Bosetti, V. Rosato, S. Gallus, J. Cuzick, C. la Vecchia; Aspirin and cancer risk: A quantitative review to 2011; Ann Oncol., 23 (6) (2012), pp. 1403–1415
- 13 S. Jafari, M. Etminan, K. Afshar; Nonsteroidal anti‐inflammatory drugs and prostate cancer: A systematic review of the literature and meta‐analysis; Can Urol Assoc J., 3 (4) (2009), pp. 323–330
- 14 K.S. Choe, J.E. Cowan, J.M. Chan, P.R. Carroll, A.V. D’Amico, S.L. Liauw; Aspirin use and the risk of prostate cancer mortality in men treated with prostatectomy or radiotherapy; J Clin Oncol., 30 (28) (2012), pp. 3540–3544
- 15 C.R. Cardwell, E.M. Flahavan, C.M. Hughes, H.G. Coleman, J.M. O'Sullivan, D.G. Powe, et al.; Low‐dose aspirin and survival in men with prostate cancer: A study using the UK Clinical Practice Research Datalink; Cancer Causes Control., 25 (1) (2014), pp. 33–43
- 16 J.S. Kasper, Y. Liu, E. Giovannucci; Diabetes mellitus and risk of prostate cancer in the health professionals follow‐up study; Int J Cancer., 124 (2009), pp. 1398–1403
- 17 K.M. Waters, B.E. Henderson, D.O. Stram, P. Wan, L.N. Kolonel, C.A. Haiman; Association of diabetes with prostate cancer risk in the multiethnic cohort; Am J Epidemiol., 169 (2009), pp. 937–945
- 18 A.J. Colquhoun, N.A. Venier, A.D. Vandersluis, R. Besla, L.M. Sugar, A. Kiss, et al.; Metformin enhances the antiproliferative and apoptotic effect of bicalutamide in prostate cancer; Prostate Cancer Prostatic Dis., 15 (2012), pp. 346–352
- 19 H. Xu, M.C. Aldrich, Q. Chen, H. Liu, N.B. Peterson, Q. Dai, et al.; Validating drug repurposing signals using electronic health records: A case study of metformin associated with reduced cancer mortality; J Am Med Inform Assoc (2014), pp. 1–10
- 20 C.H. Tseng; Metformin significantly reduces incident prostate cancer risk in Taiwanese men with type 2 diabetes mellitus; Eur J Cancer., 886 (7) (2014)
- 21 D.E. Spratt, C. Zhang, Z.S. Zumsteg, X. Pei, Z. Zhang, M.J. Zelefsky; Metformin and prostate cancer: Reduced development of castration‐resistant disease and prostate cancer mortality; Eur Urol., 63 (2013), pp. 709–716
- 22 X.X. He, S.M. Tu, M.H. Lee, S.C. Yeung; Thiazolidinediones and metformin associated with improved survival of diabetic prostate cancer patients; Ann Oncol., 22 (2011), pp. 2640–2645
- 23 T. Patel, G. Hruby, K. Badani, C. Abate-Shen, J.M. McKiernan; Clinical outcomes after radical prostatectomy in diabetic patients treated with metformin; Urology., 76 (2010), pp. 1240–1244
- 24 L. Bensimon, H. Yin, S. Suissa, M.N. Pollak, L. Azoulay; The use of metformin in patients with prostate cancer and the risk of death; Cancer Epidemiol Biomarkers Prev., 23 (10) (2014), pp. 1–8
- 25 E.H. Allott, M.R. Abern, L. Gerber, C.J. Keto, W.J. Aronson, M.K. Terris, et al.; Metformin does not affect risk of biochemical recurrence following radical prostatectomy: Results from the SEARCH database; Prostate Cancer Prostatic Dis., 16 (2013), pp. 391–397
- 26 M. Rieken, L.A. Kluth, E. Xylinas, H. Fajkovic, A. Becker, P.I. Karakiewicz, et al.; Association of diabetes mellitus and metformin use with biochemical recurrence in patients treated with radical prostatectomy for prostate cancer; World J Urol., 32 (2014), pp. 999–1005
- 27 D.A. Eisenberg; Cholesterol lowering in the management of coronary artery disease: The clinical implications of recent trials; Am J Med., 104 (1998), pp. 2S–5S
- 28 G. Papadopoulos, D. Delakas, L. Nakopoulou, T. Kassimatis; Statins and prostate cancer: Molecular and clinical aspects; Eur J Cancer., 47 (2011), pp. 819–830
- 29 M.S. Geybels, J.L. Wright, S.K. Holt, S. Kolb, Z. Feng, J.L. Stanford; Statin use in relation to prostate cancer outcomes in a population‐based patient cohort study; Prostate., 73 (2013), pp. 1214–1222
- 30 H. Moon, M.M. Hill, M.J. Roberts, R.A. Gardiner, A.J. Brown; Statins: Protectors or pretenders in prostate cancer?; Trends Endocrinol Metab., 25 (2014), pp. 188–196
- 31 T.J. Murtola, T.L. Tammela, L. Määttänen, H. Huhtala, E.A. Platz, M. Ala-Opas, et al.; Prostate cancer and PSA among statin users in the Finnish prostate cancer screening trial; Int J Cancer., 127 (2010), pp. 1650–1659
- 32 R.H. Breau, R.J. Karnes, D.J. Jacobson, M.E. McGree, S.J. Jacobsen, A. Nehra, et al.; The association between statin use and the diagnosis of prostate cancer in a population based cohort; J Urol., 184 (2010), pp. 494–499
- 33 A. Lustman, S. Nakar, A.D. Cohen, S. Vinker; Statin use and incident prostate cancer risk: Does the statin brand matter? A population‐based cohort study; Prostate Cancer Prostatic Dis., 17 (2014), pp. 6–9
- 34 O. Yu, M. Eberg, S. Benayoun, A. Aprikian, G. Batist, S. Suissa, et al.; Use of statins and the risk of death in patients with prostate cancer; J Clin Oncol., 32 (2014), pp. 5–11
- 35 D.M. Boudreau, O. Yu, D.S. Buist, D.L. Miglioretti; Statin use and prostate cancer risk in a large population‐based setting; Cancer Causes Control., 19 (2008), pp. 767–774
- 36 T.J. Murtola, T.L. Tammela, J. Lahtela, A. Auvinen; Cholesterol‐lowering drugs and prostate cancer risk: A population‐based case‐control study; Cancer Epidemiol Biomarkers Prev., 16 (2007), pp. 2226–2232
- 37 S.J. Freedland, R.J. Hamilton, L. Gerber, L.L. Banez, D.M. Moreira, G.L. Andriole, et al.; Statin use and risk of prostate cancer and high‐grade prostate cancer: Results from the REDUCE study; Prostate Cancer Prostatic Dis., 16 (3) (2013), pp. 254–259
- 38 E. Scosyrev, S. Tobis, H. Donsky, G. Wu, J. Joseph, H. Rashid, et al.; Statin use and the risk of biochemical recurrence of prostate cancer after definitive local therapy: A meta‐analysis of eight cohort studies; BJU Int., 111 (2013), pp. E71–E77
- 39 R.J. Hamilton, L.L. Banez, W.J. Aronson, M.K. Terris, E.A. Platz, C.J. Kane, et al.; Statin medication use and the risk of biochemical recurrence after radical prostatectomy: Results from the Shared Equal Access Regional Cancer Hospital (SEARCH) Database; Cancer., 116 (2010), pp. 3389–3398
- 40 A.S. Murad, L. Down, G. Davey Smith, J.L. Donovan, J. Athene Lane, F.C. Hamdy, et al.; Associations of aspirin, nonsteroidal anti‐inflammatory drug and paracetamol use with PSA‐detected prostate cancer: Findings from a large, population‐based, case‐control study (the ProtecT study); Int J Cancer., 128 (6) (2011), pp. 1442–1448
- 41 A.M. Algotar, P. Thompson, J. Ranger-Moore, M.S. Stratton, C.H. Hsu, F.R. Ahmann, et al.; Effect of aspirin, other NSAIDs, and statins on PSA and PSA velocity; Prostate., 70 (8) (2010), pp. 883–888
- 42 E. Singer, G.S. Palapattu, E. van Wijngaarden; Prostate‐specific antigen levels in relation to consumption of nonsteroidal anti‐inflammatory drugs and acetaminophen: Results from the 2001‐2002 National Health and Nutrition Examination Survey; Cancer., 113 (8) (2008), pp. 2053–2057
- 43 J.H. Fowke, S.S. Motley, J.A. Smith, M.S. Cookson, R. Concepcion, S.S. Chang, et al.; Association of nonsteroidal anti‐inflammatory drugs, prostate specific antigen and prostate volume; J Urol., 181 (5) (2009), pp. 2064–2070
- 44 S.L. Chang, L.C. Harshman, J.C. Presti; Impact of common medications on serum total prostate‐specific antigen levels: Analysis of the National Health and Nutrition Examination Survey; J Clin Oncol., 28 (25) (2010), pp. 3951–3957
- 45 U.H. Stenman, P. Finne, W.L.J. Zhang; Prostate‐specific antigen and other prostate; Urology., 4295 (56) (2000), pp. 893–898
- 46 E.M. Flahavan, K. Bennett, L. Sharp, T.I. Barron; A cohort study investigating aspirin use and survival in men with prostate cancer; Ann Oncol., 25 (1) (2014), pp. 154–159
- 47 T. Mitin, M-H. Chen, Y. Zhang, B.J. Moran, D.E. Dosoretz, M.J. Katin, et al.; Diabetes mellitus, race and the odds of high grade prostate cancer in men treated with radiation therapy; J Urol., 186 (6) (2011), pp. 2233–2237
- 48 J. Kang, M-H. Chen, Y. Zhang, B.J. Moran, D.E. Dosoretz, M.J. Katin, et al.; Type of diabetes mellitus and the odds of Gleason score 8 to 10 prostate cancer; Int J Radiat Oncol Biol Phys., 82 (3) (2012), pp. 463–467
- 49 F. Abdollah, A. Briganti, N. Suardi, A. Gallina, U. Capitanio, A. Salonia, et al.; Does diabetes mellitus increase the risk of high‐grade prostate cancer in patients undergoing radical prostatectomy[quest]; Prostate Cancer Prostatic Dis., 14 (1) (2011), pp. 74–78
- 50 D. Kaushik, R.J. Karnes, M.S. Eisenberg, L.J. Rangel, R.E. Carlson, E.J. Bergstralh; Effect of metformin on prostate cancer outcomes after radical prostatectomy; Urol Oncol., 32 (43) (2014), pp. e1–e7
- 51 M. Rieken, L. Kluth, E. Xylinas, et al.; Impact of statin use on biochemical recurrence in patients treated with radical prostatectomy; Prostate Cancer Prostatic Dis., 16 (4) (2013), pp. 367–371
- 52 M.B. Ishak-Howard, L.A. Okoth, K.A. Cooney; Statin use and the risk of recurrence after radical prostatectomy in a cohort of men with inherited and/or early‐onset forms of prostate cancer; Urology., 83 (2014), pp. 1356–1361
- 53 H.S. Park, J.D. Schoenfeld, R.B. Mailhot, M. Shive, R.I. Hartman, R. Ogembo, et al.; Statins and prostate cancer recurrence following radical prostatectomy or radiotherapy: A systematic review and meta‐analysis; Ann Oncol., 24 (6) (2013), pp. 1427–1434
- 54 A.M. Mondul, M. Han, E.B. Humphreys, C.L. Meinhold, P.C. Walsh, E. Platz; Association of statin use with pathological tumor characteristics and prostate cancer recurrence after surgery; J Urol., 185 (4) (2011), pp. 1268–1273
- 55 A.Y. Mass, I. Agalliu, J. Laze, H. Lepor; Preoperative statin therapy is not associated with biochemical recurrence after radical prostatectomy: Our experience and meta‐analysis; J Urol., 188 (3) (2012), pp. 786–791
- 56 L.S. Krane, S.A. Kaul, H.J. Stricker, J.O. Peabody, M. Menon, P.K. Agarwal; Men presenting for radical prostatectomy on preoperative statin therapy have reduced serum prostate specific antigen; J Urol., 183 (1) (2010), pp. 118–124
- 57 M. Alizadeh, M-P. Sylvestre, T. Zilli, T. Van Nguyen, J.P. Guay, J.P. Bahary, et al.; Effect of statins and anticoagulants on prostate cancer aggressiveness; Int J Radiat Oncol Biol Phys., 83 (4) (2012), pp. 1149–1153
- 58 J.L. Wright, C. Salinas, D.W. Lin, S. Kolb, J. Koopmeiners, Z. Feng, et al.; Prostate cancer specific mortality and Gleason 7 disease differences in prostate cancer outcomes between cases with Gleason 4 + 3 and Gleason 3 + 4 tumors in a population based cohort; J Urol., 182 (6) (2009), pp. 2702–2707
Document information
Published on 11/04/17
Licence: Other
Share this document
Keywords
claim authorship
Are you one of the authors of this document?